Šta je to što čini da se predmeti koje vidimo u našem okruženju razlikuju jedni od drugih? Šta je to što ih čini različitim po boji, obliku, mirisu i ukusu? Zašto je jedna supstanca meka, druga tvrda, a treća opet tečna? Na osnovu svega što smo do sada saznali u ovoj knjizi, možemo da odgovorimo na ta pitanja rečima: "Razlike između njihovih atoma to čine." Ipak, taj odgovor nije dovoljan, jer ako su atomi uzrok za te razlike, onda bi morale da postoje milijarde atoma koje nose osobine različite jedne od drugih. U praksi, to nije tako. Mnogi materijali izgledaju različiti i poseduju različite osobine, iako sadrže iste atome. Razlog za to su različite hemijske veze koje atomi formiraju između sebe da bi nastali molekuli.
Na putu do materije, molekuli su drugi korak posle atoma. Molekuli su najmanje jedinice koje određuju hemijske osobine materije. Ova mala tela sačinjena su od dva ili više atoma, a neka od više hiljada grupa atoma. Atomi se unutar molekula drže zajedno povezani hemijskim vezama i određenom elektromagnetnom silom privlačenja, što znači da se te veze formiraju u skladu sa električnim naelektrisanjem atoma. Električna naelektrisanja atoma su, zauzvrat, određena elektronima iz njihove ljuske koja je najbliža površini. Raspored molekula u različitim kombinacijama proizvodi raznovrsnost materije koju vidimo oko sebe. Značaj hemijskih veza koje leže u srcu raznovrsnosti materije vidi se na ovom mestu.
Kako je maločas objašnjeno, hemijske veze formiraju se kretanjem elektrona u elektronskim ljuskama koje su najbliže površini atoma. Svaki atom teži da svoju ljusku najbližu površini popuni maksimalnim brojem elektrona koju ona može da primi. Osam je maksimalni broj elektrona koje atomi mogu da drže u svojim ljuskama najbližim površini. Da bi to učinili, atomi ili primaju elektrone od drugih atoma da bi do osam popunili elektrone u svojim ljuskama najbližim površini, ili ako imaju manje elektrona u svojim spoljašnjim ljuskama oni ih daju drugom atomu, proizvodeći podljusku koja je prethodno bila popunjena u njihovim spoljnim orbitama. Težnja atoma da razmenjuju elektrone čini osnovnu pokretačku silu hemijskih veza koje oni međusobno formiraju.
Ta pokretačka sila, to jest, težnja atoma da povećaju broj elektrona u svojim spoljašnjim ljuskama do maksimuma, čini da atom formira tri tipa veze sa drugim atomima. To su jonska veza, kovalentna veza i metalna veza.
Obično, posebne veze koje se podvode pod opšti naziv "slabe veze", deluju između molekula. Te veze su slabije od veza koje formiraju atomi da bi načinili molekule, jer su molekulima potrebne savitljivije strukture koje bi formirale materiju.
Razmotrimo ukratko osobine i formiranje tih veza.
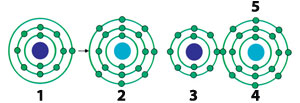 | |
| 1) Sodium atom | 4) Chlorine ion |
| Natrijumov atom daje svoj spoljašnji elektron atomu hlora i postaje pozitivno naelektrisan. Primajući elektron, atom hlora postaje negativno naelektrisan. Oni formiraju jonsku vezu pomoću ta dva suprotna naelektrisanja koja se međusobno privlače. 24 | |
Atomi koji se kombinuju ovom vezom razmenjuju elektrone i tako do broja osam broj elektrona u svojim spoljašnjim ljuskama. Atomi koji imaju do četiri elektrona u svojim spoljaštnjim ljuskama daju te elektrone atomu sa kojim će se kombinovati, to jest, sa kojim će se vezati. Atomi koji imaju više od četiri elektrona u svojim spoljašnjim ljuskama primaju elektrone od atoma sa kojim će formirati vezu. Molekuli formirani ovim tipom veze imaju kristalne (kockaste) strukture. Poznati molekuli kuhinjske soli (NaCl) su među supstancama koje su formirane ovom vezom. Zašto atomi imaju takvu težnju? Šta bi se desilo kada je ne bi imali?
Veze formirane od strane atoma mogle bi se do danas definisati samo veoma opštim terminima. Još uvek nije shvaćeno zašto se atomi drže tog principa. Da li možda atomi sami odlučuju da broj elektrona u njihovim spoljašnjim ljuskama treba da bude osam? Svakako ne. Takav oblik odlučivanja ide iznad atoma, jer on nema intelekt, volju ili svest. Taj broj je ključ u kombinacijama atoma kao molekula koji čine prvi korak u stvaranju materije, i u krajnjem slučaju, svemira. Kada atomi ne bi imali težnju zasnovanu na tom principu, molekuli, a takođe i materija, ne bi postojali. Ipak, od prvog trenutka u kome su stvoreni, atomi su zahvaljujući toj težnji savršeno služili u procesu formiranja molekula i materije.
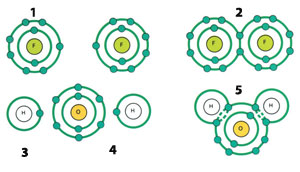 | |
| 1) Fluorine atom | 3) Hydrogen atom |
| Neki atomi formiraju nove molekule kovalentnim vezama, deleći elektrone u svojim spoljašnjim orbitama.25 | |
Naučnici koji su proučavali veze između atoma naišli su na zanimljivu situaciju. Dok neki atomi razmenjuju elektrone radi povezivanja, neki od njih dele elektrone u svojim spoljašnjim ljuskama. Dalja istraživanja otkrila su da mnogi molekuli koji imaju odlučujući značaj za život duguju za svoje postojanje tim "kovalentnim" vezama.
Jednostavan primer pomoći će nam da bolje objasnimo kovalentne veze. Kao što smo ranije rekli do smo razmatrali pojam elektronskih ljuski, atomi mogu maksimalno da nose dva elektrona u svojim unutrašnjim elektronskim ljuskama. Atom vodonika ima samo jedan elektron i teži da poveća broj svojih elektrona na dva da bi postao stabilan atom. Prema tome, atom vodonika formira kovalentnu vezu sa drugim atomom vodonika. To jest, dva atoma vodonika dele jedan elektron između sebe kao svoj drugi elektron. Tako se formira molekul vodonika (H2).
Ako se veliki broj atoma spoji međusobnom deobom elektrona, to se zove "metalna veza". Metali kao što su gvožđe, bakar, cink, aluminijum, itd, koji formiraju građu mnogih alata i instrumenata, koje zapažamo oko sebe ili ih koristimo u svakodnevnom životu, stekli su čvrsto i opipljivo telo kao rezultat metalnih veza koje formiraju atomi koji ih čine.
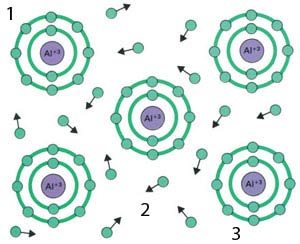 | 1) Metallic Bonding |
| Veze između atoma metala veoma se razlikuju od drugih formi hemijskog vezivanja - svaki atom metala prilaže svoje spoljašnje elektrone zajedničkom pulu. Ovo "more elektrona" objašnjava ključnu osobinu metala - njihovu sposobnost da provode elektricitet.26 |
Naučnici nisu u mogućnosti da nam odgovore na pitanje zašto elektorni u elektronskim atomskim ljuskama imaju takve težnje. Živi organizmi, što je vrlo zanimljivo, duguju svoje postojanje toj težnji.
Da li se pitate, koliko različitih jedinjenja te veze mogu da formiraju?
U laboratorijama se svakoga dana proizvode nova jedinjenja. Trenutno, moguće je govoriti o oko skoro dva miliona jedinjenja. Najprostija hemijska jedinjenja mogu da budu mala kao molekul vodonika, dok istovremeno postoje jedinjenja sačinjena od više miliona atoma.27
Koliko najviše različitih jedinjenja može da formira jedan element? Odgovor na to pitanje je veoma zanimljiv, jer, sa jedne strane, postoje određeni elementi koji ne stupaju u reakciju ni sa jednim drugim elementom (inertni gasovi), dok sa druge strane, postoji atom ugljenika koji može da formira 1.700.000 jedinjenja. Kako je već napomenuto, ukupan broj jedinjenja je oko dva miliona. Od ukupnog broja od 109, 108 elemenata formiraju 300.000 jedinjenja. Ugljenik, međutim, formira 1.700.000 jedinjenja na najneverovatniji način.
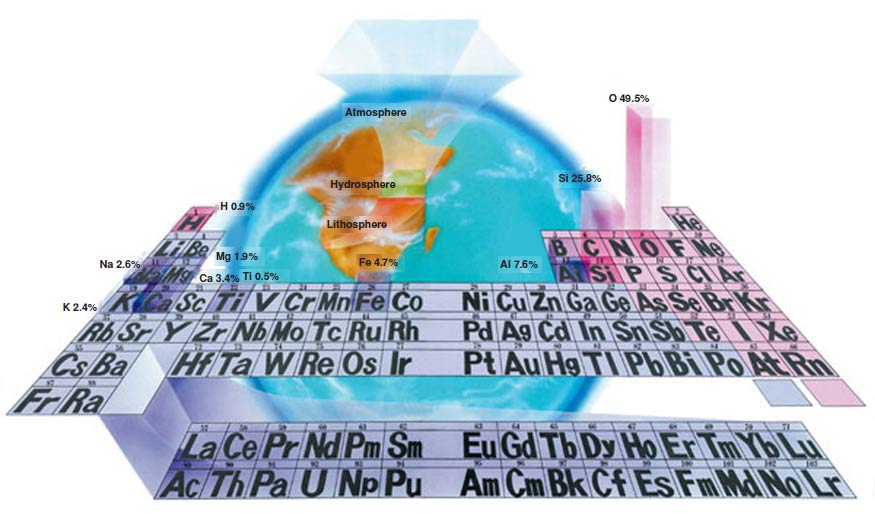 |
| Gradivni materijal svemira i periodni sistem: 92 elementa koji postoje slobodni u prirodi i 17 elemenata veštački formiranih u laboratorijama ili u nuklearnim reakcijama raspoređeni su prema svom broju protona na tabeli nazvanoj "periodni sistem". Na prvi pogled, periodni sistem može da izgleda kao gomila kutija koje sadrže jedan ili dva slova sa brojevima u gornjim i donjim uglovima. Međutim, najzanimljivije je da ta tabela sadrži elemente celokupnog svemira, uključujući vazduh koji dišemo, kao i naše telo. |
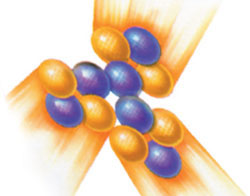 |
| Carbon atom |
Ugljenik je najznačajniji element za živa bića, jer svi živi organizmi u svom sastavu sadrže jedinjenje ugljenika. Brojne strane jedne ovakve knjige ne bi bile dovoljne za opisivanje osobina atoma ugljenika, koji je veoma značajan za naše postojanje. Hemija kao nauka do sada nije bila u mogućnosti da otkrije sva njegova svojstva. Ovde ćemo spomenuti samo nekoliko veoma značajnih svojstava ugljenika.
Raznovrsne strukture kao što su ćelijske membrane, jelenski rogovi, stablo drveta, očna sočiva, otrov pauka sačinjene su od jedinjenja ugljenika. Ugljenik, kombinovan sa vodonikom, kiseonikom i azotom u mnoštvu različitih odnosa i geometrijskim rasporedima, pojavljuje se u ogromnoj količini materijala sa veoma različitim osobinama. Odakle takva sposobnost ugljenika da formira približno 1,7 miliona jedinjenja?
Jedna od najznačajnijih osobina ugljenika je njegova sposobnost da veoma lako formira lance postavljanjem svojih atoma jedan za drugim u liniju. Najkraći ugljenikov lanac sastavljen je od dva atoma ugljenika. Uprkos nemogućnosti za određivanje preciznog broja atoma ugljenika koji sačinjavaju najduži lanac ugljenika, možemo da govorimo o lancu sa 70 veza. Ako znamo da je atom koji može da formira najduži lanac, posle atoma ugljenika - atom silicijuma, koji formira 6 veza, tada će izuzetno mesto atoma ugljenika biti bolje shvaćeno.28
Razlog sposobnosti ugljenika da formira lance sa toliko veza nalazi se njegovim lancima koji nisu isključivo linearni. Lanci mogu da budu razgranati, a takođe mogu da formiraju zatvorene nizove.
Oblik lanca, na ovom mestu, ima veoma značajnu ulogu. Na primer, u dva jedinjenja ugljenika, ako su njegovi atomi u istom broju, a ipak kombinovani kao različiti oblici lanaca, formiraju se dve različite supstance. Gore pomenute karakteristike atoma ugljenika proizvode molekule koji su veoma značajni za život.
Neki molekuli jedinjenja ugljenika sastoje se od samo nekoliko atoma; drugi sadrže hiljade ili čak milione. Ni jedan drugi element nije toliko raznovrstan kao ugljenik u formiranju molekula velike trajnosti i stabilnosti. Da navedemo reči Dejvida Brnija (David Burnie) iz njegove knjige $Život$ (Life):
"Ugljenik je veoma neobičan element. Bez prisustva ugljenika i njegovih neobičnih osobina, malo je verovatno da bi život na Zemlji postojao."29
Tri slična molekula Rezultat: tri veoma različite supstance: |
| Čak i razlika od nekoliko atoma između molekula daje veoma različite rezultate. Na primer, pažljivo pogledajmo dva molekula koja su dole napisana. Oba izgledaju slično, osim veoma malih razlika u njihovim komponentama ugljenika i vodonika. Rezultat su dve potpuno suprotne supstance: C18H24O2 i C19H28O2Da li možete da pogodite koji su ovo molekuli? Reći ćemo vam odmah: prvi je estrogen, drugi je testosteron. To jest, prvi je hormon odgovoran za ženske karakteristike, a drugi je hormon odgovoran za muške karakteristike. Najzanimljivije je da čak i razlika od nekoliko atoma može da prouzrokuje polne razlike. C6H12O2Zar ovaj molekul ne liči na molekule hormona estrogena i testosterona? Šta predstavlja taj molekul, da li je to još jedan hormon? Odgovorimo odmah: To je molekul šećera. Iz primera ova tri molekula koji su izgrađeni od elemenata istog tipa, veoma je jasno koliko su raznovrsne supstance koje može da proizvede razlika u broju atoma. U jednu ruku, postoje hormoni odgovorni za polne karakteristike, dok u drugu ruku, postoji šećer, kao osnovna hrana. |
Uzimajući u obzir značaj ugljenika za žive organizme, britanski hemičar Nevil Sidžvik (Nevil Sidgwick) piše u knjizi $Hemijski elementi i njihova jedinjenja$ (Chemical Elements and Their Compounds):
"Ugljenik je jedinstven među elementima po broju i raznovrsnosti jedinjenja koje može da formira. Preko četvrt miliona je već bilo izolovano i opisano, ali to daje veoma nesavršenu ideju njegovih mogućnosti, pošto je on osnova svih oblika žive materije." 30
 |
| Dijamant, koji je veoma vredan kamen, je derivat ugljenika, koji se inače obično nalazi u prirodi kao grafit. |
Klasa jedinjenja koja se formira isključivo od ugljenika i vodonika naziva se "ugljovodonici". Ovo je velika familija jedinjenja koja sadrži prirodan gas, tečni petrolej, kerozin i mazivna ulja. Ugljovodonik etilen i propilen formiraju osnovu petrohemijske industrije. Ugljovodonici kao što su benzen, toulen i terpentin poznati su svakome ko je radio sa bojama. Naftalin koji štiti našu odeću od moljaca je još jedan ugljovodonik. Ugljovodonici kombinovani sa hlorom ili fluorom formiraju anestetike, zatim hemikalije koje se koriste prilikom gašenja požara, i freone koji se koriste u hladnjacima.
Kako je hemičar Sidžvik napomenuo, ljudski um nema dovoljno mogućnosti da u potpunosti shvati potencijal ovog atoma koji ima samo 6 protona, 6 neutrona i 6 elektrona. Nemoguće je da se čak i samo jedna osobina ovog atoma, koji je neophodan za život, slučajno formira. Tvorac je oformio atom ugljenika, kao i sve ostalo, savršeno prilagođen za tela živih organizama, o kojima Tvorac brine sve do njihovih atoma.
What is in the heavens and in the earth belongs to Allah. Allah encompasses all things. (Surat an-Nisa': 126)
Šta bi se dogodilo kada bi svaki atom koji stoji blizu jedan do drugoga trenutno reagovao? | |
| We just said that the whole universe is formed by the interaction of the atoms of 109 different elements. Here, there is a point that needs to be mentioned, which is that a very important condition must be fulfilled for the reaction to start.
Upravo smo rekli da je ceo svemir formiran međusobnim dejstvom atoma 109 različitih elemenata. Ovde postoji tema koja treba da bude spomenuta. Ta tema odnosi se na obavezno ispunjenje veoma značajnih uslova da bi reakcija mogla da otpočne. Na primer, voda se uvek ne formira kad se kiseonik i vodonik nađu blizu jedan drugoga, i gvožđe ne rđa čim dođe u kontakt sa vazduhom. Kada bi to bilo tako, gvožđe, koje je čvrst i sjajan metal, transformisalo bi se u roku od nekoliko minuta u meki prah oksida gvožđa, koji je meki prah. Ne bi ostao nikakav metal na Zemlji i poredak u svetu veoma bi se izmenio. Kada bi se atomi koji se nalaze blizu jedan drugoga, na određenoj daljini, sjedinili trenutno bez ispunjenja određenih uslova, atomi dve različite supstance bi međusobno trenutno reagovali. U tom slučaju bilo bi nemoguće čak i za vas da sedite u stolici, jer bi atomi koji formiraju stolicu trenutno reagovali sa atomima koji formiraju vaše telo i vi bi ste postali biće između stolice i čoveka (!). Naravno, u takvom svetu, život ne bi bio moguć. Kako je takav ishod izbegnut? Da damo jedan primer: molekuli vodonika i kiseonika reaguju veoma sporo na sobnoj temperaturi. To znači da se voda na sobnoj temperaturi formira veoma sporo. Ipak, kako temepratura sredine raste, energija molekula takođe raste i reakcija se ubrzava, tako da se voda značajno brže formira. Minimalna količina energije potrebna da molekuli međusobno reaguju naziva se "aktivaciona energija". Na primer, da bi molekuli vodonika i kiseonika u svojoj reakciji formirali vodu, njihova energija mora da bude veća od aktivacione energije. Da malo razmislimo. Ako bi na Zemlji temperatura bila malo viša, atomi bi prebrzo reagovali, što bi uništilo ravnotežu u prirodi. Da je suprotno tačno, to jest da je temperatura na Zemlji niža, atomi bi u tom slučaju reagovali previše sporo, što bi ponovo poremetilo ravnotežu u prirodi. Iz toga se može zaključiti da je udaljenost Zemlje od Sunca upravo odgovarajuća za održavanje života na njoj. Ipak, osetljive ravnoteže potrebne za život se tu ne završavaju. Nagib Zemljine ose, njena masa, površina, proporcija gasova u atmosferi, udaljenost između Zemlje i njenog satelita - Meseca, i mnogi drugi faktori moraju da očuvaju potpunu preciznost u svojim sadašnjim vrednostima da bi živi organizmi mogli da prežive. Ovo ukazuje na činjenicu da svi ovi faktori nisu mogli da se formiraju progresivno, prostim slučajem, i da su svi stvoreni od strane Tvorca, Vlasnika superiorne moći, koji poznaje sve osobine živih organizama. Uloga nauke tokom tih procesa je samo u tome da imenuje zakone fizike koje uočava. Kako smo objasnili na početku, prilikom pojave takvih fenomena, pitanja kao što su "Šta", "Kako" i "Na koji način", postaju beznačajna. Ono što možemo da dosegnemo ovim pitanjima su samo detalji već postojećih zakona. Glavna pitanja koja treba da budu postavljena su "Zašto" i "Ko je stvorio taj zakon"? Odgovor na ova pitanja ostaje enigma za naučnike koji se slepo vezuju za svoje materijalističke dogme. Na ovom mestu, na kome materijalisti dolaze u ćorsokak, slika je veoma jasna za osobu koja otvorenim umom i svešću prati događaje. Nepogrešiva ravnoteža u svemiru, koju je nemoguće objasniti kao slučajnosti, nastala je od strane Tvorca. |
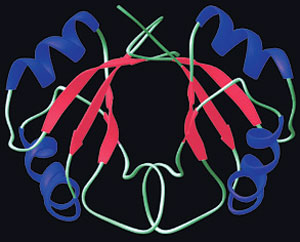 |
| Proteini moraju da imaju posebne trodimenzionalne konfiguracije da bi mogli da ostvare svoje delikatne uloge koje imaju u našem telu. Slabe veze između molekula formiraju te strukture. |
Veze koje povezuju atome u molekule mnogo su jače od tih slabih međumolekularnih veza. Te veze pomažu formiranje miliona i čak milijardi vrsta molekula. Kako se molekuli slažu da bi formirali materiju?
Pošto molekuli posle svog formiranja postaju stabilni, više ne razmenjuju atome. Šta ih onda drži zajedno?
U pokušaju da odgovore na to pitanje, hemičari su postavili različite teorije. Istraživanje je pokazalo da molekuli mogu da se kombinuju na različite načine što zavisi od osobina atoma i njihovog sastava.
Te veze su veoma značajne za organsku hemiju, koja predstavlja hemiju živih organizama, jer su najznačajniji molekuli koji izgrađuju život formirani zbog njihove sposobnosti da uspostavljaju te veze. Uzmimo primer proteina. Složeni trodimenizionalni oblici proteina, koji su u stvari gradivni blokovi živih sistema, formiraju se zahvaljujući tim vezama. To znači da je slaba hemijska veza između molekula neophodna za formiranje života makar isto toliko koliko i jaka hemijska veza između atoma. Naravno, jačina tih veza mora da ima određenu meru.
Možemo da nastavimo razmatranje primera proteina. Molekuli koji se zovu amino-kiseline slažu se tako da formiraju proteine, koji su mnogo veći molekuli. Atomi koji formiraju amino-kiseline složeni su kovalentnim vezama. Slabe veze kombinuju te amino-kiseline na takav način da proizvode trodimenzionalne obrasce. Proteini mogu da funkcionišu u živim organizmima samo ako imaju te trodimenizonalne obrasce. Prema tome, kada te veze ne bi postojale, ne bi postojali ni proteini, a samim tim ni život.
"Vodonična" veza, tip slabe veze, igra veliku ulogu u formiranju materijala koji imaju veliki značaj u našem životu. Na primer, molekuli koji formiraju vodu, koja je osnov života, slažu se vodoničnim vezama.
 |
| Do you not see that Allah sends down water from the sky and forthwith the earth is covered in green? Allah is All-Subtle, All-Aware. (Surat al-Hajj: 63) |
Tečnost naročito odabrana za život, "voda", pokriva dve trećine naše Zemlje. Tela svih živih organizama na Zemlji formirana su od ove veoma specifične tečnosti u odnosu koji varira između 50%-95%. Od bakterija koje žive u izvorima sa temperaturom blizu tačke ključanja vode, do nekih posebnih mahovina na lednicima koji se tope, život je prisutan svuda gde postoji voda, bez obzira na kojoj temperaturi. Čak se i u jednoj kapi vode koja visi sa lista posle kiše, pojavljuje hiljade mikroskopski živih organizama, koji se razmnožavaju i umiru.
Kako bi Zemlja izgledala kada ne bi bilo vode? Svakako, svuda bi bila pustinja. Postojali bi ambisi i strašne jame na mestima gde su sada mora. Nebo bi bilo bez oblaka i imalo neobičnu boju.
U stvari, vodi, osnovi života na Zemlji, veoma je teško da se formira. Prvo, zamislimo da se molekuli vodonika i kiseonika, koji su sastojci vode, stave u staklenu posudu. Ostavimo ih u posudi veoma dugo vremena. Ovi gasovi mogu još uvek da ne formiraju vodu čak i ako ostanu u posudi stotinama godina. Čak i ako je formiraju, ne bi je bilo više od male količine na samom dnu posude i to bi se vrlo sporo odigralo, možda posle više hiljada godina.
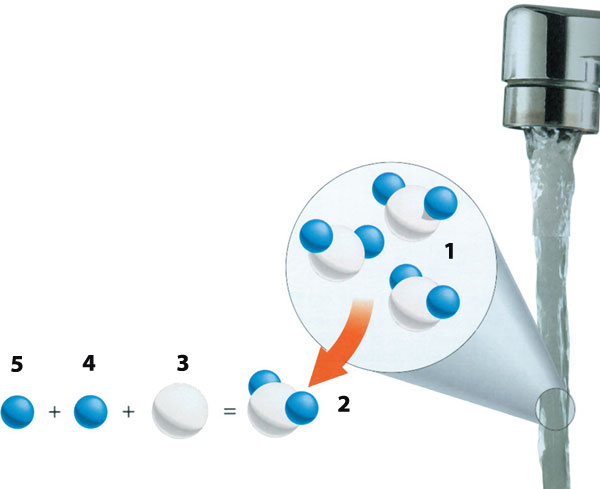 | ||
| 1) Water Molecule | 3) Oxygen | 5) Hydrogen |
Temperatura je razlog zbog koga se u ovim uslovima voda formira tako sporo. Na sobnoj temperaturi, kiseonik i vodonik reaguju veoma sporo.
Kada su slobodni, kiseonik i vodonik nalaze se kao H2 i O2 molekuli. Da bi se složili da formiraju molekul vode, moraju da se sudare. Kao rezultat tog sudara, veze koje formiraju molekule vodonika i kiseonika slabe i time otvaraju mogućnost kombinovanja atoma kiseonika i vodonika. Temperatura povećava energiju, i prema tome brzinu ovih molekula, a rezultat je porast broja sudara. Tako ona ubrzava tok reakcije. Međutim, na Zemlji trenutno ne postoji temperatura dovoljno velika da omogući formiranje vode. Toplota potrebna za formiranje vode obezbeđena je tokom formiranja Zemlje, što je omogućilo pojavu količine vode dovoljne da pokrije tri četvrtine Zemljine površine. Trenutno voda isparava i diže se u atmosferu u kojoj se hladi i vraća na Zemlju u obliku kiše. Dakle, nema povećanja količine, već samo neprekidno kruženje.
 |
| Da voda nema osobinu zaleđivanja od površine prema dnu, veliki deo mora bio bi zamrznut tokom jedne godine i život u moru bi bio ugrožen. |
Voda ima veliki broj izuzetnih hemijskih osobina. Svaki molekul vode formira se slaganjem atoma vodonika i kiseonika. Veoma je zanimljivo da se ta dva gasa, jedan zapaljiv i drugi koji pomaže prilikom sagorevanja, kombinuju da bi formirali tečnost, i što je najzanimljivije - vodu.
Pogledajmo sada ukratko kako se voda hemijski formira. Električno naelektrisanje vode je nula, to jest, voda je neutralna. Ipak, usled veličine atoma kiseonika i vodonika, kiseonik u molekulu vode ima blago negativno naelektrisanje, a vodonik blago pozitivno. Kada više od jednog molekula vode dospe blizu jedan drugom, pozitivna i negativna naelektrisanja se međusobno privlače i tako formiraju veoma posebnu vezu poznatu kao "vodonična veza". Vodonična veza je veoma slaba veza i izuzetno kratkoga veka. Trajanje vodonične veze iznosi približno stotrilioniti deo sekunde. Međutim, čim se veza prekine, druga se formira. Tako molekuli vode ostaju povezani, dok istovremeno zadržavaju svoj tečan oblik, jer su kombinovani slabom vezom.
Vodonične veze, takođe, omogućavaju vodi da se odupire temperaturnim promenama. Čak iako temperatura vazduha iznenada poraste, temperatura vode lagano raste, i slično tome, ako temperatura vazduha iznenada padne, temperatura vode pada sporo. Potrebne su velike temperaturne promene da bi se proizvele značajne promene temperature vode. Značajno velika toplotna energija vode donosi velike koristi u životu. Evo jednog svakodnevnog primera: U našem telu postoji velika količina vode. Kada bi se voda istom stopom prilagođavala iznenadnim promenama temperature vazduha, mi bi odmah dobili groznicu ili bismo se smrzli.
 |
| Pošto je gustina zamrznute vode manja nego kod vode u tečnom stanju, led pluta po vodi. |
Na isti način, vodi je za isparavanje potrebna velika toplotna energija. Pošto voda angažuje veliki deo toplotne energije dok isparava, njena temperatura pada. Da spomenemo primer, opet iz funkcije ljudskog tela: normalna temperatura tela je 36oC, a najveća telesna temperatura koju možemo da tolerišemo je 42oC. Ovaj interval od 6oC je zaista veoma mali; čak i rad pod Suncem u toku nekoliko sati telo može za taj iznos da poveća telesnu temperaturu. Ipak, našu telo troši veliku količinu toplotne energije kroz znojenje, to jest, omogućavajući vodi koju ono sadrži da isparava, što doprinosi snižavanju telesne temperature. Da naše telo nema takav automatski mehanizam, rad od samo nekoliko sati pod suncem mogao bi da izazove neželjene posledice.
Vodonične veze daju vodi još jednu neobičnu osobinu - voda je viskoznija u svom tečnom stanju nego u svom čvrstom stanju. U stvari, većina supstanci na Zemlji je viskoznija u svom čvrstom stanju nego u tečnom. Međutim, suprotno od drugih supstanci, voda se širi dok se zamrzava. To je zbog toga što vodonične veze sprečavaju da se molekuli vode previše blizu vezuju jedni sa drugima. Tako ostavljaju velike praznine između njih. Vodonične veze se raspadaju kada je voda u tečnom stanju, a to čini da atomi kiseonika priđu bliže jedni drugima i formiraju viskozniju strukturu.
To takođe čini da je led lakši od vode. Normalno, ako topite bilo koji metal i bacite u njega nekoliko čvrstih delova istog metala, ti delovi bi neposredno potonuli na dno. Međutim, kod vode prilike su drugačije. Ledeni bregovi koji teže desetine hiljada tona plutaju na vodi kao čepovi. Kakve koristi nam obezbeđuje ta osobina vode?
Odgovorimo na ovo pitanje primerom reke: kada je vreme veoma hladno, zamrzava se samo površina reke, a ne sva voda u koritu. Voda dostiže najveću težinu na +4oC, i čim dostigne tu temperaturu, trenutno se spušta na dno. Led se formira na površini vode kao sloj. Pod ovim slojem voda nastavlja da teče i pošto je +4oC temperatura na kojoj živi organizmi mogu da prežive, život u vodi se nastavlja. Ove jedinstvene osobine koje je Tvorac dao vodi čine život mogućim na Zemlji.
It is He Who sends down water from the sky. From it you drink and from it come the shrubs among which you graze your herds. And by it He makes crops grow for you and olives and dates and grapes and fruit of every kind. There is certainly a Sign in that for people who reflect. (Surat an-Nahl: 10-11)
Svi znamo da voda ključa na 100oC i zamrzava se na 0oC. U stvari, pod normalnim okolnostima, voda bi trebao da ključa ne na 100oC, već na +180oC. Zašto?
U periodnom sistemu, osobine elemenata u istoj grupi variraju na progresivan način od lakih elemenata prema težim. Ovaj red je najočigledniji kod jedinjenja vodonika. Jedinjenja elemenata koja dele istu grupu sa kiseonikom na periodnoj tabeli zovu se "hidridi". U stvari, voda je "hidrid kiseonika". Hidridi drugih elemenata u toj grupi imaju iste molekularne strukture kao molekul vode.
Tačke ključanja tih jedinjenja variraju na progresivan način od sumpora ka težim; međutim, tačka ključanja vode neočekivano odudara od tog obrasca. Voda (hidrid kiseonika) ključa na 80oC manje nego što je očekivano. Još jedna iznenađujuća situacija nastaje u vezi sa tačkom smrzavanja vode. Ponovo, po redosledu u periodnom sistemu, voda bi trebalo da se smrzava na -100oC. Ipak, voda krši to pravilo i smrzava se na 0oC, 100oC iznad temperature na kojoj bi trebalo. To navodi na pitanje zašto ni jedan drugi hidrid, već samo voda (hidrid kiseonika) ne poštuje pravila periodnog sistema.
 |
| Molekuli na površini tečnosti imaju silu koja ih usmerava u unutrašnjost. To je površinski napon. On obezbeđuje kohezionu silu između površinskih molekula, koja je dovoljno velika da spreči da noge vodene bube propadaju. Visok površinski napon vode je neophodan za odvijanje fizioloških procesa.31 |
Zakoni fizike, zakoni hemije i sve druge stvari koje imenujemo kao zakone samo su pokušaji objašnjenja izvanredne ravnoteže u svemiru i detalja stvaranja. Celokupno istraživanje izvršeno u 21. veku pokazuje više nego ikad da su sve fizičke ravnoteže u svemiru stvorene po meri za život čoveka. Istraživanje otkriva da su svi zakoni fizike, hemije i biologije koji preovladavaju u svemiru, kao i atmosfera, Sunce, atomi i molekuli, itd, raspoređeni upravo onako kako je potrebno da bi postojao ljudski život. Voda, kao i drugi gore pomenuti elementi, prilagođena je da doprinosi životu do te mere, da se ne može porediti sa bilo kojom drugom tečnošću i veliki deo Zemlje ispunjen je vodom u tačno odgovarajućim količinama potrebnim za život. Očigledno je da sve ovo ne mogu biti slučajnosti i da se i ovde iskazuje savršeni red i dizajn koji preovladava u svemiru.
Zapanjujuće fizičke i hemijske osobine vode otkrivaju da je ta tečnost stvorena posebno za život čoveka.
Kiseonik (02) nalazi se u donjoj atomosferi i u procesu disanja daje život svim bićima. Ozon (03) je otrovan gas veoma neprijatnog mirisa. Nalazi se u najvišim slojevima atmosfere. Kada bismo morali da udišemo ozon umesto kiseonika, niko od nas ne bi preživeo.
Ozon je u gornjoj atmosferi, jer tamo ima veoma važnu funkciju u prilog održanja života. On formira sloj na visini od oko 20 km iznad Zemljine površine i okružuje Zemlju kao pojas. Apsorbuje ultraljubičaste zrake koje Sunce emituje, sprečavajući ih da u punom intenzitetu dosegnu do Zemlje. Pošto ultraljubičasti zraci nose veoma veliku energiju, njihov direktan kontakt sa Zemljom prouzrokovao bi da sve na Zemlji izgori, ne dozvoljavajući da se život nesmetano odvija. Iz tog razloga, ozonski sloj služi kao zaštitni štit u afmosferi.
 | |
| 4) O3 | Kako hlor uništava ozon?Hlor reaguje sa ozonom, proizvodeći molekul kiseonika i hipohloratni jon (OCl-) (1). Ovaj jon reaguje sa atomom kiseonika (2) da bi oslobodio slobodan hlor (3), koji može da reaguje i uništi drugi molekul ozona.32 |
Da bi se život održao na Zemlji, sva bića moraju da budu u mogućnosti da dišu i budu zaštićena od štetnih Sunčevih zraka. Onaj koji formira taj sistem je Tvorac, koji vlada nad svakim atomom, svakim molekulom. Bez Božje intervencije, ne bi postojala sila koja bi te atome u različitim proporcijama spojila kao što su molekuli gasa kiseonika i ozona.
Molekuli čiji ukus i miris osećamo
Osećaji ukusa i mirisa su osobine koje čine ljudski svet lepšim. Zadovoljstvo koje potiče iz ovih čula bilo je tema interesovanja od drevnih vremena, a tek nedavno otkriveno je da su ona prouzrokovana međusobnim dejstvom molekula.
"Ukus" i "miris" su jedini osećaji koji su stvoreni pomoću različitih molekula u našim čulnim organima. Na primer, miris hrane, pića ili različitog voća i cveća koje zapažamo oko sebe, sastoje se od isparljivih molekula. Kako se to dešava?
 |
PiperinPiperin je aktivni sastojak belog i crnog bibera (bobice tropske puzavice $Piper nigrum$). Crni biber se dobija tako što se pusti da nezreo plod fermentira, a zatim se suši. |
Isparljivi molekuli kao što su miris vanile i miris ruže stižu do receptora koji se nalaze na pokretnim dlačicama u nosnom regionu poznatom kao epitel i reaguju sa tim receptorima. To međusobno dejstvo opaža se kao miris u našem mozgu. Do sada je u našoj nosnoj šupljini, koja je oivičena mirisnom membranom veličine 2-3 cm2, otkriveno sedam različitih tipova receptora. Svaki od ovih receptora odgovara jednom osnovnom mirisu. Na isti način, postoje četiri različita tipa hemijskih receptora u prednjem delu našeg jezika. To odgovara slanom, slatkom, kiselom i gorkom ukusu. Naš mozak opaža dolazak molekula do receptora naših čulnih organa kao hemijske signale.
 |
Para-hidroksifenil-2-butanon i jononMešavina ova dva molekula proizvodi veoma prijatan miris. Butanon je molekul uglavnom odgovoran za miris zrelih malina. Sveži miris tek ubranog voća delom nastaje usled jonona, koji je takođe odgovoran za miris pokošenog sena i ljubičice. Jonon je mirisni sastojak ulja ljubičice.34 |
Otkriveno je kako se ukus i miris opažaju i kako se formiraju, pa ipak naučnici do sada nisu bili u mogućnosti da se dogovore oko toga zašto neke supstance imaju jak miris dok neke imaju slabiji i zašto neke imaju dobar ukus, a neke loš.
 |
FurilmetanetiolOvaj molekul je jedan od onih koji su odgovorni za miris kafe. Stimulativno dejstvo kafe nastupa kofeina. Boja prženih zrna kafe nastaje uglavnom zbog hemijske reakcije koja se javlja kada se zagrevaju organske supstance koje sadrže azot. Privremeno zarobljeni u okviru zrna nalaze se molekuli odgovorni za miris i stimulaciju.35 |
Razmislimo za trenutak. Mogli bismo da živimo u svetu bez ukusa i mirisa. Pošto ne bismo imali ideju o konceptima ukusa i mirisa, ne bi nam čak ni na pamet palo da poželimo da imamo te opažaje. Međutim, to nije tako. Iz tamne zemlje izlaze sa jedinstvenim mirisom stotine tipova aromatičnih i ukusnih plodova, povrća i cveća, i hiljade boja, oblika i mirisa. Zašto se onda ti atomi, koji se sa jedne strane spajaju, slažu, na neobične načine da bi formirali materiju, a sa druge strane, a sa druge strane kombinuju, da proizvedu ukus i miris? Iako ih često bez razmišljanja uzimamo i ne mislimo o tome koliko nam oni čine veliku uslugu, oni kao produkti veličanstvene umetnosti prijatno doprinose našem svetu.
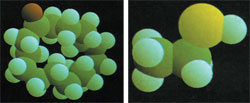 |
| Gornja slika pripada molekulu neprijatnog mirisa, a slika levo mirisnom molekulu. Kao što možemo da vidimo, ono što razlikuje neprijatan miris od prijatnog su te male razlike u mikrokosmosu koji je nevidljiv za nas. |
Što se tiče drugih bića, neka jedu samo travu, a neka različitu hranu. Naravno, nijedna od njih ne miriše lepo, niti ima dobar ukus. Čak i da imaju, to mnogo ne znači tim bićima, pošto nemaju svest u smislu u kome to imaju ljudska bića. Mi bismo takođe mogli da se hranimo samo jednim tipom ishrane. Da li ste ikada razmišljali koliko bi običan i bezukusan vaš život bio ako biste morali da jedete jednu vrstu hrane celoga života i pijete samo vodu? Prema tome, ukus i miris su, kao i svi drugi blagoslovi, lepote koje nam je dao Tvorac. Odsustvo samo ova dva čula učinilo bi ljudski život prilično tmurnim.
And when your Lord announced: "If you are grateful, I will certainly give you increase, but if you are ungrateful, My punishment is severe." (Surah Ibrahim: 7)
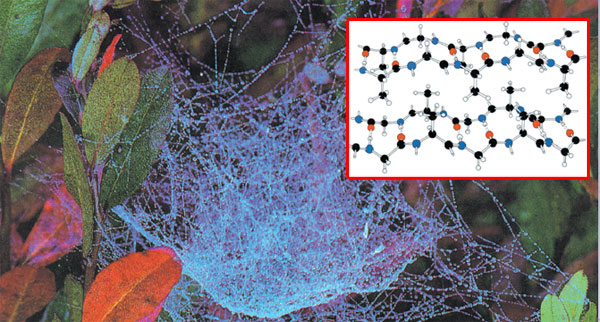 |
b-keratinSvila, uobičajeno ime b-keratina, za očvrslu tečnost koju izlučuje veliki broj insekata i paukova, od kojih je najvrednija izlučevina svilene bube - gusenice svilenog leptira. To je polipeptid koji se uglavnom sastoji od glicina, alanina i manjih količina drugih amino-kiselina. Molekuli b-keratina ne formiraju zavojnicu; umesto toga, oni leže na vrhu, jedan preko drugog, jer tako daju čvrste ploče vezanih amino-kiselina, sa glicinima koji se javljaju samo na jednoj strani ploče. Ploče stoje na vrhu drugih. Ova prostorna struktura oseća se kada dodirnete glatku površinu svile.36 |
What we have told so far has revealed that what we call matter is not an entity having a specific colour, smell and form, as we believed it to be. What we imagine to be matter, that is our own body, our room, our home, and at large, the world and the whole universe, is in reality nothing but energy. What is it then that makes everything around us visible and touchable?
The reason why we perceive the things around us as matter is the collision of electrons in the orbital shells of atoms with photons, and the atoms' attracting and repelling each other.
You are not even touching the book that you think you hold in your hand right now… In truth, the atoms of your hand are repelling the atoms of the book and you feel a sense of touch depending on the intensity of this repulsion. As we mentioned while talking about the structure of atoms, they can come close to each other at most as much as the diameter of an atom. Besides, the only atoms that can come this close are those that react with each other. Therefore, when even atoms of the same substance can by no means touch each other, it is all the more impossible for us to touch the substance we hold, squeeze or lift with our hand. In fact, if we could come as close as possible to the object in our hand, we would be involved in a chemical reaction with that object. In this case, it would be impossible for a human being or another living being to survive even for a second. The living being would immediately react with the substance on which he stepped, sat or leaned, and be transformed into something else.
The final picture that emerges in this situation is extremely remarkable: we live in a world that is 99.95 % composed of a void filled with atoms consisting almost entirely of energy.37 We actually never touch the things we say, "we touch and we hold". So, to what extent do we perceive the matter we see, hear or smell? Are these substances really as we see or hear them? Absolutely not. We had addressed this point when we talked about electrons and molecules. Remember, it is literally impossible for us to see the matter we believe to exist and see, because the phenomenon we call seeing comprises certain images formed in our brain by photons coming from the sun, or from another light source, hitting the matter, which absorbs a certain portion of the incoming light, and gives out the rest, which therefore is re-emitted from the matter and strikes our eyes. That is to say that the matter we see only consists of the information carried by photons that are reflected to our eye. So, how much of the data related to matter is conveyed to us by this information? We have no proof that the original forms of the matters existing outside are fully reflected to us.
24. Martin Sherwood & Christine Sulton, The Physical World, Oxford University Press, 1988, p. 81 
25. Martin Sherwood & Christine Sulton, The Physical World, Oxford University Press, 1988, p. 82
26. Martin Sherwood & Christine Sulton, The Physical World, Oxford University Press, 1988, p. 79
27. L. Vlasov, D. Trifonov, 107 Stories About Chemistry, 1977, p. 117
28. L. Vlasov, D. Trifonov, 107 Stories About Chemistry, 1977, p. 118
29. David Burnie, Life, Eyewitness Science, London: Dorling Kindersley, 1996, p.8
30. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol.1, Oxford: Oxford University Press, 1950, p.490
31. Martin Sherwood & Christine Sulton, The Physical World, Oxford University Press, 1988, p. 30
32. Structure of Matter, The Time Inc. Book Company, 1992, p. 76
33. P.W. Atkins, Molecules, Scientific American Library, p. 115
34. P.W. Atkins, Molecules, Scientific American Library, p. 128
35. P.W. Atkins, Molecules, Scientific American Library, p. 130
36. P.W. Atkins, Molecules, Scientific American Library, p. 93
37. Taşkın Tuna, Uzayın Ötesi (Beyond Space), Boğaziçi Yayınları, 1995, p. 166