Tek dallojmë se në çfarë mënyre të jashtëzakondshme janë programuar ligjet e natyrës për të krijuar universin, shohim se ky univers nuk është krijuar kot por prapa tij fshihet një mendje dhe qëllim. Xhon Polkinghorn, fizikant anglez84 84
 |
Deri tani shqyrtuam se të gjitha ekuilibrat fizikë të universit në të cilin jetojmë janë të programuar posaçërisht për jetën tonë. Pamë gjithashtu se struktura e përgjithshme e universit, pozicioni i Tokës brenda tij, vetitë fizike të kores së tokës dhe faktorët si ajri, uji dhe drita janë projektuar posaçërisht me ato cilësi që ne kemi nevojë. Por përveç këtyre na duhet të analizojmë edhe elementët organikë, përbërës të trupit tonë. Edhe ato elemente përbërës të dorës, syve, flokëve, organeve apo të të gjithë atyre gjallesave që na si-gurojnë ushqim bimëve, kafshëve, pemëve dhe zogjve, janë projektuar posaçërisht për të shërbyer pikërisht aty ku vlejnë.
Fizikanti Robert E. D. Klark me shprehjen e tij “Krijuesi ka krijuar pjesë të veçanta për ndërtimin e jetës”85, tregon se Zoti ka krijuar me një projektim suprem dhe të veçantë të gjitha bazat e jetës.
Baza më e rëndësishme këtu është karboni.
Në kapitujt e kaluar shpjeguam se karboni, i cili zë vendin e 6-të në tabelën periodike, prodhohej në ato yje të mëdhenj që i quanim gjigandët e kuq me një proces tepër fantastik. Pamë se edhe Fred Hoil që zbuloi këtë proces të mahnitshëm deklaroi se "nëse do të vlerësonim këto procese që ndodhin nëpër yje mund të themi se ligjet e fizikës janë të organizuar në mënyrë të vullnetshme".85
 |
| Në shumicën e rasteve karboni në natyrë gjendet në formën e grafitit. Kjo lëndë e zezë në komponime me atome të tjerë formon lëndë jashtëzakonisht të ndryshme dhe të larmishme. Materiali, i cili formon trupin e njeriut dhe të çdo gjallese tjetër është karboni me lidhjet që krijon me disa elemente të tjerë. |
Në studimet e bëra mbi karbonin këtë vullnet nuk e shohim vetëm në procesin e formimit të tij por edhe në sistemin e vetive fizike të këtij elementi.
Karboni i lirë (i pastër) në natyrë gjendet në dy forma të veçanta; si grafit dhe si elmaz. Me përzierjet e kryera, karboni formon substanca të llojeve të ndryshme. Të gjitha ato struktura organike të ndryshme që nga bërthamat qelizore në lëvoren e pemës, nga thjerrëzat e syve në brirët e drerit, nga e bardha e vezës në helmin e gjarprit, përbëhen nga komponime me bazë karbonin. Karboni i kombinuar në forma gjeometrike dhe radhitjeve të ndryshme në përzierje me hidrogjenin, oksigjenin dhe azotin, nxjerr në pah substanca tepër të larmishme dhe të ndryshme.
Komponimet karbonike në disa raste përbëhen vetëm nga disa atome e në disa të tjera prej mijëra madje miliona atomesh. Vetëm atomet e karbonit mund të formojnë komponime të tilla të gjata dhe të qëndrueshme (jetëgjatë). Ashtu siç e deklaron edhe David Burni në librin Life "karboni është element i jashtëzakondshëm... nëse nuk do të ishte karboni dhe këto veçori të tij, jeta në tokë do të ishte e pamundur".86
Kimisti anglez Nevil Sixhvik në librin me titull “Chemical Elements and Their Compounds (Elementet kimike dhe komponimet e tyre)” shkruan për karbonin se:
Për arsye të veçorive fizike dhe kimike do të ishte e pamundur mbështetja e jetës në një element tjetër në vend të karbonit. Dihet shumë mirë se edhe silikoni, i cili dikur u paraqit si alternativë e karbonit, ishte një kandidat i pavlefshëm. Sixhvik thotë se "sot zotërojmë dije të mjaftueshme dhe jemi të bindur se do të ishte e pamundur një ide e zëvendësimit, si bazë për jetën, e silikonit me karbonin".87
For reasons of both physics and chemistry, it is impossible for life to be based on any element other than carbon. At one time, silicon was proposed as another element on which life might be based. We now know however that this conjecture is impossible. To quote Sidgwick again:
We know enough now to be sure that the idea of a world in which silicon should take the place of carbon as the basis of life is impossible…88
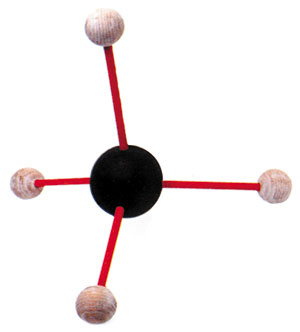 |
| Struktura e gazit metan: Përreth atomit të karbonit në mes, janë lidhur katër atome të njëjtë hidrogjeni. |
Lidhje kovalente, është emri që u jepet lidhjeve midis atomeve në përzierjet e karbonit me atome të tjera për formimin e komponimeve organike. Një lidhje kovalente formohet me përpjesëtimin e elektroneve të dy atomeve.
Elektronet zenë vend nëpër orbita të caktuara përreth bërthamës së atomit. Në orbitën më afër bërthamës mund të marrin pjesë vetëm dy elektrone. Në orbitën pasuese marrin pjesë tetë elektrone dhe një më pas saj 18 elektrone e kështu me radhë. Interesante është se elektronet janë të epur për të përmbushur numrin e caktuar të çdo orbite. Psh, oksigjeni, i cili në orbitën e tij të dytë zënë vend 6 elektrone, kërkon vazhdimisht që të shtojë edhe dy elektrone të tjerë për të përmbushur numrin tetë në këtë orbitë. Akoma nuk është gjetur një përgjigje për këtë aftësi (elasticitet) të atomeve por dihet se po të mos ishte diçka e tillë nuk do të ekzistonin organizmat e gjalla.
Lidhjet kovalente formohen në saje të kësaj dëshire të atomeve për të “plotësuar orbitat”. Dy atome të ndryshme, të cilët që të dy kërkojnë të plotësojnë orbitat e tyre, e arrijnë diçka të tillë duke përpjesëtuar elektronet mes njëri-tjetrit. Psh, dy atome hidrogjeni dhe një atom oksigjeni që formojnë molekulën e ujit (H2O) krijojnë mes tyre një lidhje kovalente. Oksigjeni duke përpjesëtuar çdonjërin elektron të dy atome-ve të hidrogjenit, plotëson numrin tetë në orbitën e tij të dytë. Po ashtu, çdonjëri prej hidrogjeneve duke përdorur secili nga një elektron oksigjeni, plotësojnë orbitën e tyre të parë me nga dy elektrone.
Ja pra, edhe karboni duke kryer lidhje të tilla kovalente formon substanca të shumëllojshme. Njëri prej tyre është edhe metani. Metani formohet me lidhjen kovalente të katër atomeve të ndryshme të hidrogjenit me karbonin. Numri atomik i karbonit është 6 dhe në vend të oksigje-nit, i cili kishte 8 dhe i mungonin dy, karbonit i duhet që të kryejë lidhje me katër hidrogjene.
Thamë se karboni është veçanërisht i shumanshëm në formimin e lidhjeve me atome të tjerë duke shfaqur një numër jashtëzakonisht të madh komponimesh. Vetëm me komponimet që kryhen me hidrogjenin, formon një familje tepër të gjërë që quhen “hidrokarbure”. Në këtë familje marrin pjesë: gazi natyror, nafta e lëngët, vajguri dhe (vajra) lubrifikantë të ndryshëm. Hidrokarbure si etileni dhe popileni janë bazë në industrinë petrokimike. Hidrokarbure si benzeni, tolueni dhe turpentini përdoren nëpër bojëra. Naftalina është një tjetër hidrokarbur, të cilin e përdorim për të mbrojtur teshat tona nga mola. Hidrokarburet, të cilët përzihen me klorin apo fluorin, formojnë substanca të ndryshme si lëndë anestezike, shuajtës zjarri dhe freon që e përdorim nëpër frigoriferë.
Komponimet e karbonit me hidrogjenin dhe oksigjenin zenë përsëri një vend të gjerë. Në këtë familje marrin pjesë alkoole si, etanoli dhe propanoli, aldehidet, ketonet dhe acidet e yndyrshme. Dy substanca të tjera që hyjnë në këtë familje të komponimeve karbonike me hidrogjenin dhe oksigjenin janë glukoza dhe fruktoza që na sigurojnë energji nga ushqimet që hajmë. Po ashtu edhe lënda e ashpër (sertë) e pemëve njëkohësisht lënda e parë për letër, celuloza, dylli, uthulla si dhe acidet formike janë secila nga një komponim i lidhjeve kovalente të karbonit me hidrogjenin dhe oksigjenin.
Në lidhjet që formon karboni me hidrogjenin, oksigjenin dhe azotin përsëri shfaqen komponime tepër të rëndësishme për ne. Në krye të këtyre komponimeve radhiten aminoacidet, të cilat formojnë proteinat bazë për trupin tonë. Edhe molekulat nukleotide që formojnë ADN-në, janë komponime të përzierjes së karbonit me hidrogjenin, oksigjenin dhe azotin.
When carbon, hydrogen, oxygen, and nitrogen form such bonds, the result is a class of molecules that is the foundation and structure of life itself: the amino acids that make up proteins. The nucleotides that make up DNA are also molecules formed from carbon, hydrogen, oxygen, and nitrogen.
Shkurtimisht lidhjet kovalente që kryen atomi i karbonit janë kusht i domosdoshëm për ekzistencën e jetës. Nëse karboni nuk do të kishte aftësinë të formonte lidhje kovalente me hidrogjenin, oksigjenin dhe azotin as që nuk do të bëhej fjalë për jetë.
 |
| Vaji i ullirit, mishi apo sheqeri janë lëndë të ndryshme, të cilat formohen me programime të ndryshme të komponimeve të karbonit, oksigjenit, hidrogjenit apo azotit. |
Ajo që e mundëson (kushtëzon) karbonin të kryejë lidhje të tilla është karakteristika e tij që kimistët e quajnë “metastabël”. Këtë karakteristikë të karbonit, biokimisti i njohur J. B. S. Haldane e shpjegon kështu:
"Qenia metastabël e një molekule do të thotë çlirimi i një energjie të lirë gjatë një transformimi dhe mbetja e saj stabël për një kohë të gjatë por duke përjashtuar këtu ndërhyrjet në reaksion të temperaturës, rrezatimit apo të një kata-lizatori".89
Ky përkufizim teknik do të thotë se atomi i karbonit zotëron një strukturë tepër të veçantë. Në saje të kësaj strukture në kushte normale, karboni mund të formojë lidhje kovalente shumë lehtësisht.
Na tërheq vëmendjen këtu një pikë interesante. Karakteristika në fjalë, e domosdoshme për jetën e karbonit, realizohet vetëm në një interval shumë të ngushtë temperature. Komponimet karbonike mbi 100°C janë të paqëndrueshëm.
Uji dhe metani: Dy shembuj të ndryshëm të lidhjeve kovalente |
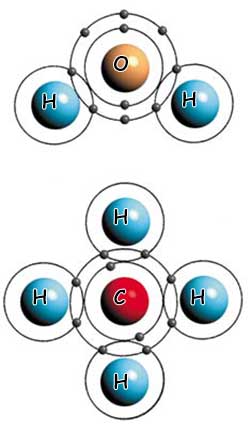 |
| Molekula e ujit (sipër) është formuar nga lidhje kovalente midis një atomi të oksigjenit dhe dy atomeve të hidrogjenit. Kurse molekula e metanit (poshtë) është formuar nga lidhja kovalente midis një atomi të karbonit dhe katër atomeve të hidrogjenit. |
Këtë gjë e vërejmë që të gjithë në jetën tonë të përditshme. Ajo që ne bëjmë kur skuqim mish s’është asgjë tjetër vetëm ndryshimi struktural i komponimeve të karbonit. Por duhet t’iu tërheqim vëmendjen në një pikë; mishi që skuqet kthehet në një gjendje plotësisht “të vdekur”, për shkak se aty zhduket çdo strukturë e gjallë e organizmave. Kështu që komponimet karbonike shkatërrohen mbi 100°C. Një pjesë e madhe e vitaminave shkatërrohet menjëherë, po ashtu edhe sheqernat pësojnë po të njëjtat ndryshime strukturale dhe i humbasin plotësisht të gjitha vlerat ushqimore. Në një temperaturë më të lartë psh, në 150°C, komponimet karbonike fillojnë dhe digjen.
Krijimi dhe ruajtja e stabilitetit të lidhjeve kovalente të komponimeve karbonike nuk e kalojnë kufirin e sipërm prej 100°C dhe kufirin e poshtëm të intervalit të temperaturës që është 0°C. Në një temperaturë poshtë 0°C është e pamundur ekzistenca e biokimisë organike.
Komponimet e tjera nuk janë kështu. Në shumicën e rasteve për lëndët inorganike nuk ndodhin ndikime të tilla në ndryshimet e temperaturës. Për të parë diçka të tillë, pranë një cope mishi vendosni një copë metali, xhami apo një gur dhe ngroheni. Me rritjen e temperaturës do të vëreni se struktura e mishit po ndryshon, skuqet, nxihet dhe në fund digjet. Diçka e tillë nuk mund të ndodhë te metali, xhami apo te guri edhe në qoftë se e rrisim me qindra gradë temperaturën.
Nëse e shikoni me kujdes, nevoja për intervalin e duhur të temperaturës për formimin dhe mbrojtjen e lidhjeve kovalente të komponimeve karbonike, është pikërisht ajo temperaturë që ekziston në Tokë. Siç e kemi cilësuar edhe më parë, temperatura në univers ndryshon që nga temperatura e yjeve të zjarrtë që arrin në nxehtësira me miliarda gradë deri në pikën “absolute zero” –273.15°C. Në një kohë kur Toka, e cila është krijuar posaçërisht për jetën njerëzore, zotëron pikërisht në një interval aq të ngushtë atë temperaturë të nevojshme për komponimet karbonike, bazë për jetën.
Një anë tjetër më interesante është se po ky interval është e vetmja tempe-raturë e gjendjes së lëngshme të ujit. Ashtu siç e pamë edhe në kreun e kaluar edhe për ujin, i cili është një nga bazat e jetës nevojitet po i njëjti interval temperature që i duhet edhe komponimeve të karbonit. Nuk ekziston asnjë ligj i natyrës që të kushtëzojë një përshtatje të tillë. Kjo, është një tregues që uji, karboni dhe veçoritë e tokës janë të krijuara në harmoni me njëra-tjetrën.
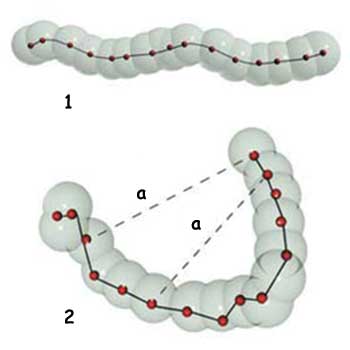 |
| 1. Lidhja kovalente: Atomet janë të lidhur ngushtë me njëri-tjetrin. 2. Lidhja e dobët: Zinxhiri atomik i një komponenti në pika të ndryshme është i mbajtur në një formë të vetme tri-dimensionale. |
| a. Lidhje e dobët |
Lidhjet, të cilat i mbajnë të ngjitura së bashku atomet e trupave organike nuk janë lidhjet kovalente. Ekziston edhe një klasë e dytë e lidhjeve. Tërësisë së këtyre lidhjeve me llojshmëri të ndryshme u jepet emri “lidhjet e dobëta”.
Lidhjet e dobëta janë pothuejse 20 herë më të pafuqishme se lidhjet kovalente por që zotërojnë një rëndësi të veçantë në kiminë organike. Proteinat, të cilat janë bazë të trupave të qenieve të gjalla, format e tyre tri-dimensionale të ndërlikuara i fitojnë në saje të lidhjeve të dobëta.
Për të shpjeguar diçka të tillë duhet të thellohemi në strukturën e proteinave. Proteinat në përgjithësi njihen si “zinxhirë aminoacidesh”. Një përkufi-zim i tillë bëhet sepse ato janë të rreshtuara njëri pas tjetrit, si rruazat e një varëseje në një seri dy-dimensionale.
Lidhjet kovalente mbajnë lidhur me njëri-tjetrin ato atome që formojnë aminoacidet. Lidhjet e dobëta bashkojnë aminoacidet në format e duhura tri-dimensionale. Po të mos ishin lidhjet e dobëta do të ishte e pamundur qenia e proteinave. Në një ambient që nuk ndodhen proteinat nuk mund të flitet për jetë.
Interesante është se temperatura e duhur e lidhjeve të dobëta është po e njëjta temperaturë e duhur edhe për lidhjet kovalente dhe se është pikërisht ajo temperaturë që zotëron atmosfera e Tokës. Struktura e lidhjeve të dobëta është krejtësisht ndryshe me të lidhjeve kovalente dhe nuk ka asnjë arsye të natyrshme që të kushtëzojë nevojën e tyre për të njëjtën temperaturë. Megjithatë të dyja këto klasa lidhjesh formohen në të njëjtin interval temperature. Nëse lidhjet kovalente dhe lidhjet e dobëta do të tregonin stabilitet në intervale të ndryshme temperature ndërtimi i proteinave do të ishte përsëri i pamundur.
Të gjithë këto informacione, të cilat i shtjelluam mbi veçoritë e jashtëzakondshme të atomit të karbonit, tregojnë se mes këtij atomi bazë materiale e jetës, me ujin, i cili është një tjetër material bazë i jetës dhe Tokën, si planet strehues të jetës, ekziston një harmoni tepër e madhe. Majkëll Denton në librin e tij “Natyre’s Destiny (Fati i Natyrës)” e thekson kështu këtë fakt:
"Brenda vlerave kaq gjigande të temperaturës është një interval i ngushtë tempe-rature që brenda tij arrijmë të zotërojmë
1) ujin në gjendje të lëngët
2) karakteristikën metastabël për sigurimin e komponimeve të ndryshme dhe të larmishme organike dhe
3) stabilitetin e lidhjeve të dobëta me format e ndërlikuara molekulare tri-dimensionale". 90
Ky interval i ngushtë temperature, ashtu siç e kemi cilësuar edhe më parë, midis trupave qiellorë që njihen ekziston vetëm në Tokë. Gjithashtu edhe ato dy baza shumë të rëndësishme për jetën, uji dhe karboni, gjenden në sasira të bollshme në tokë.
Të gjitha këto tregojnë se atomi i karbonit me të gjitha veçoritë e tij të jashtëzakondshme, është krijuar posaçërisht për jetën dhe se Toka është programuar për një jetë me bazë karbonin.
Pamë se karboni është baza më e rëndësishme e organizmave të gjalla dhe se është krijuar për këtë funksion të tij, me një projektim të veçantë. Por ekzistenca e të gjitha qenieve të gjalla me bazë karbonin është e lidhur edhe pas një kushti të dytë: energjisë. Energjia është nevojë e domosdoshme për jetën.
Bimët e gjelbërta energjinë e marrin nga drita e Diellit. Kurse për kafshët dhe njerëzit burimi i energjisë sigurohet prej “oksidimit”. Duke “djegur” ushqimin bimor fitojmë energji. Pra, siç mund ta kuptojmë edhe nga vetë termi i oksidimit, djegia realizohet me praninë e oksigjenit në reaksion. Për këtë arsye edhe oksigjeni është një bazë për jetën e ndërlikuar ashtu si uji dhe karboni.
Formula e reaksionit të “djegies” që çliron energji është:
komponime karbonike + oksigjen --> ujë + dioksid karboni + energji
Në përfundimin e reaksionit të mësipërm, pranë ujit dhe dioksidit të karbonit çlirohet edhe një sasi e konsiderueshme energjie. Në krye të komponimeve karbonike vijnë hidrokarburet, të përbëra nga atome karboni dhe hidrogjeni. Psh, glukoza (sheqeri) është një hidrokarbur, i cili vazhdimisht “digjet” në trupin tonë dhe është bazë e sigurimit të energjisë.
Interesante është se atomet e hidrogjenit dhe karbonit që formojnë hidrokarburet janë atomet më të përshtatshme për t’u oksiduar. Hidrogjeni midis të gjithë atomeve të tjerë kur oksidohet çliron më tepër energji. E thënë ndryshe është “lënda djegëse” më e mirë për oksigjenin. Karboni në aftësinë e tij si lëndë djegëse është i treti, pas boronit. Henderson, autori i librit “The "The Fitness of the Environment (Përshtatshmëria e Mjedisit)" ka deklaruar se ka mbetur tepër i mahnitur përballë kësaj "përshtatjeje të dobishme të jashtëzakondshme" dhe shkruan se: "Reaksionet kimike, të cilat japin rezultatet më të përshtatshme që mund të jenë, për fiziologjinë, në të njëjtën kohë janë reaksione që i përcjellin më mirë energji organizmave". 91
 |
Siç e prekëm edhe më sipër, reaksionet më themelore që u sigurojnë energji qenieve të gjalla janë oksidimet që pësojnë komponimet e karbonit me hidro-gjenin. Në këtë pikë mund të formulojmë një pyetje interesante: Edhe trupi ynë në bazë, është i formuar nga komponimet e karbonit me hidrogjenin. Atëherë përse nuk oksidohet edhe trupi ynë? Apo e shprehur më qartë, përse trupi ynë nuk merr flakë dhe të ndizet si një fije shkrepëse?
Në të vërtetë është një rast tepër habitës që trupi ynë tek kontakton me oksigjenin nuk digjet.
Ky paradoks ndodh për shkak se shumica e molekulave të oksigjenit në temperatura normale, të cilat zotërojnë formën O2, janë molekula “të paafta” dhe nuk hyjnë dot në reaksione me substanca të tjera. (“Të paafta” është një term që përdoret nga kimistët për ato gaze që i kanë të plotësuara orbitat e tyre me elektrone, prandaj emërtohen si “të paafta” apo” të ngopura” sepse aftësia e një atomi për të hyrë në reaksion përcaktohet nga elasticiteti që tregon ky atom për të plotësuar vendet boshe të elekroneve nëpër orbitat rreth bërthamës.) Por këtu lind përsëri një pyetje tjetër: Meqë O2 është një molekulë që nuk merr pjesë lehtësisht nëpër reaksione, si arrin trupi ynë ta kthejë këtë molekulë në një trajtë që të hyjë në reaksion?
Përgjigjja e kësaj pyetjeje, e cila pritej me padurim që prej shekullit të 19-të, ka arritur të kuptohet nga zhvillimet e shkencës së gjysmës së dytë të shekullit të 20-të. Vëzhgimet biokimike zbuluan se disa enzima të veçanta në trupin tonë janë të ngarkuara me detyrën për të futur në reaksion formën O2 të oksigjenit që gjendet i lirë në atmosferë. Këto enzima të veçanta, nëpër qelizat tona si rezultat i proceseve tepër të ndërlikuara, sjellin në gjendje reaktive oksigjenin duke përdorur si katalizator (përshpejtues) atomet e bakrit dhe hekurit që gjenden në trupin tonë.92
Është një tabllo tepër interesante: Oksigjeni është një element djegës dhe normalisht pritet që edhe trupi ynë të digjet. Për të parandaluar këtë, në një mënyrë habitëse oksigjeni në atmosferë me formën e tij O2 është "i paaftë" dhe nuk hynë lehtësisht në reaksion. Por që trupi ynë të përfitojë energji, ka nevojë për ve-tinë djegëse të oksigjenit. Për këtë gjë brenda qelizave tona është vendosur një sistem enzime i ndërlikuar që këtë gaz të paaftë ta kthejë në një gjendje tepër reaktive.Meqë jemi brenda temës duhet të theksojmë se ky sistem enzime është një mrekulli e projektimit dhe që i hedh poshtë pretendimet e teorisë së evolucionit mbi formimin e rastësishëm të gjallesave.93
Ekziston edhe një masë tjetër e marrë nga trupi ynë për të parandaluar djegien e tij. Kjo, me thënien e kimistit Nevil Sixhvik, është "karakteristika inerte e karbonit".94 E thënë ndryshe, në temperatura normale karboni nuk merr pjesë lehtësisht në reaksion me oksigjenin. Kjo karakteristikë e shprehur në gjuhën kimike në të vërtetë është diçka që ne e përjetojmë çdo çast në jetën tonë. Vështirësitë që heqim tek mundohemi për të ndezur zjarr duke përdorur dru apo qymyr në një ditë të ftohtë, shkaktohen nga kjo veti e karbonit. Për të ndezur zja-rrin duhet që të mundohemi për të ngritur nxehtësinë e druve apo të qymyrit. Por pasi zjarri merr flakë, karboni hyn me shpejtësi në reaksion dhe çliron një energji të madhe. Prandaj për të ndezur zjarr (pa ndihmën e një shkrepëseje apo të një burimi tjetër zjarri) është tepër e vështirë. Mbasi zjarri lëshon flakët e para, ai rritet me shpejtësi duke çliruar një nxehtësi të madhe dhe fillon të djegë çdo komponim karbonik përreth.
Nëse e vërejmë me kujdes, në zjarr do të shohim një projektim tepër interesant. Vetitë kimike të oksigjenit dhe karbonit janë të programuara në atë mënyrë që edhe pse zotërojnë veti tepër djegëse, hyjnë në reaksion dhe shkaktojnë zjarr vetëm në temperatura shumë të larta. Po të mos ishte kështu jeta mbi Tokë do të ishte e pamundur. Nëse epërsia e oksigjenit dhe e karbonit do të ishte disi më e madhe, me rritjet e temperaturës në Tokë do të krijohej një katastrofë e vërtetë ku të gjithë njerëzit, pemët, kafshët do të merrnin flakë në çast dhe do të ishte diçka normale. Psh, një njeri që ecën në shkretëtirë në atë çast kur temperatura e ditës ngrihet në kulmin e saj, do të digjej në çast si fije shkrepseje. Po ashtu edhe bimët e kafshët do të kishin po të njëjtat pasoja. Padyshim që të flitet për jetë në një botë të tillë do të ishte pak e vështirë.
Nëse karakteristikat pasive të oksigjenit dhe karbonit do të ishin më të mëdha, do të ishte tepër e vështirë të ndizej zjarr mbi tokë, mbase mund të ishte edhe e pamundur. Në një mjedis ku nuk ndodhet zjarri do të ishte e pamundur ngrohja e njerëzve si edhe zhvillimi i teknollogjisë. Sepse siç dihet teknollogjia mbështetet në metale dhe metalet mund të zbuten e marrin formë vetëm në temperatura tepër të larta.
Kjo gjendje na shfaq edhe njëherë që vetitë kimike të oksigjenit dhe karbonit janë në format më të përshtatshme për jetën e njeriut. Në këtë kuadër Majkëll Denton shkruan:
"Midis elasticitetit që tregohet për të mos hyrë në reaksion, i atomeve të oksigjenit dhe karbonit në temperatura normale, dhe energjisë me përmasa gjigande që çlirohet kur këto hyjnë në reaksion, ekziston një programim tepër i rëndësishëm për jetën në tokë. Ky programim kaq interesant i oksigjenit dhe karbonit siguron përfitimin e një energjie në një mënyrë të vazhdueshme dhe të kontrolluar të organizmave të ndërlikuara dhe në të njëjtën kohë njerëzimi të arrijë ta përdori në mënyrë të kontrolluar zjarrin duke përfituar temperaturat e duhura për teknollogjinë".95
E thënë ndryshe, si oksigjeni edhe karboni janë krijuar në formën më të përshtatshme për jetën tonë. Veçoritë e këtyre dy elementeve na japin mundësinë që të mund të ndezim zjarr dhe këtë zjarr ta përdorim në mënyrën më të përshtatshme. Çdo anë e tokës është e mbushur me pemë që përmbledhin sasira të konsiderueshmë karboni dhe që ne mund t’i përdorim lehtësisht për të ndezur zjarr. Të gjitha këto tregojnë se edhe zjarri me materialet e tjera janë të krijuara në formën më të përshtatshme për jetën humane. Allahu në Kuran u drejtohet në këtë mënyrë njerëzve:
"Ai që prej drurit të gjelbër ju bëri zjarrin, e ju prej tij ndizni". (Jasin, 80)
Përdorimi i oksigjenit nga trupi ynë arrihet si rrjedhojë e vetisë së tretshmërisë së këtij gazi në ujë. Tek marrim frymë oksigjeni që hyn në mushkëritë tona tretet menjëherë dhe përzihet me gjakun. Proteina e quajtur hemoglobinë pasi i lokalizon këto molekula të tretura oksigjeni, i shpërndan nëpër qeliza. Nga ana tjetër qelizat në saje të atij sistemi të veçantë enzime që e prekëm më lart, përfitojnë energji duke përdorur këtë oksigjen për të djegur ato komponime organike që quhen ATP.
Të gjitha organizmat e ndërlikuara përfitojnë energji në këtë sistem. Por si-gurisht që ky sistem të funksionojë është i lidhur ngushtë me vetinë tretëse të oksigjenit. Në qoftë se oksigjeni nuk do të tretej mjaftueshëm, në gjak do të hynin sasira shumë të vogla oksigjeni dhe kjo nuk do të përmbushte nevojat e qelizave për energji. Nëse oksigjeni do të ishte më i tretshëm, përqindja e oksigjenit në gjak do të rritej tej mase dhe do të shfaqej “helmimi i oksidimit”.
Interesante është se përqindja e tretshmërisë midis gazeve ndryshon 1 mi-lion herë. Pra, midis gazit më të tretshëm dhe atij më pak të tretshëm ekziston një diferencë tretshmërie prej 1 milion herë. Pothuajse asnjë gaz nuk zotëron vlera tretshmërie të njëjta me tjetrin. Psh, dioksidi i karbonit ka një tretshmëri 20 herë më të madhe në krahasim me oksigjenin. Brenda këtyre vlerave kaq të ndryshme tretshmërie oksigjeni zotëron pikërisht ato vlera më të përshtatshme për jetën tonë.
Çfarë do të ndodhte nëse tretshmëria e oksigjenit do të ishte pak më e vogël apo e madhe?
Le të shohim fillimisht mundësinë e parë. Nëse oksigjeni në ujë (dhe rrje-dhimisht në gjak) do të tretej disi më pak, në gjak do të përzihej më pak oksigjen dhe qelizat nuk do të merrnin sasinë e duhur të oksigjenit. Në një situatë të tillë do të ishte shumë e vështirë jetesa e qenieve të gjalla me një metabolizëm të lartë si njeriu. Në këtë gjendje le të marrim sa të duam frymë, për shkak se oksigjeni që thithim nuk arrin mjaftueshëm nëpër qeliza, do të mbesnim ballë për ballë me rrezikun e mbytjes.
Nëse tretshmëria e oksigjenit do të ishte më e madhe do të shfaqej “helmimi prej oksidimit”, të cilin e përmendëm më lart. Faktikisht oksigjeni është një gaz shumë i rrezikshëm dhe në kushte mbi kufinjtë normalë zotëron efekte vdekjeprurëse për gjallesat. Me rritjen e përqindjes së oksigjenit në gjak, ky oksigjen duke hyrë në reaksion me ujin shfaqen produkte anësore tepër reaktive dhe shkatërruese. Në trup janë sistemet tepër të ndërlikuar të enzimave që eleminojnë këtë efekt të oksigjenit. Por nëse përqindja e oksigjenit do të rritej këto sisteme do të ishin të padobishëm dhe sa herë që të merrnim frymë duke e helmuar pak nga pak trupin tonë në një kohë të shkurtër do të shkonim drejt vdekjes. Kimisti Irvajn Fridoviç mbi këtë çështje thotë:
Të gjitha organizmat që kryejnë frymëmarrje kanë rënë në një kurth tepër interesant. Oksigjeni, i cili favorizon jetën e tyre në të njejtën kohë ka veti helmuese (toksike) për to dhe vetëm në saje të disa mekanizmave të veçanta e tepër delikate mbrojtëse arrin të shmangë këtë rrezik. 96
Ja pra, ajo që na mbron prej rrezikut të kurthit në fjalë, pra, prej helmimit nga oksigjeni dhe të mbytjes prej mungesës së tij është krijimi dhe përcaktimi i përqindjes së tretshmërisë së oksigjenit dhe sistemi i ndërlikuar i enzimave në trup, pikërisht ashtu siç nevojitet. E thënë ndryshe, Allahu ka krijuar me një përshtatje të përsosur, si ajrin që ne marrim frymë po ashtu edhe ato sisteme që si-gurojnë përdorimin e tij.
 |
| Cooper |
Padyshim që elementet e projektuara posaçërisht për jetën nuk janë të kufizuar vetëm me karbonin dhe oksigjenin. Edhe elemente si hidrogjeni apo azoti që përbëjnë përsëri një pjesë të madhe të trupit të qenieve të gjalla, zotërojnë veçori të caktuara që mundësojnë jetën organike. Faktikisht të gjithë elementeve të tabelës periodike në këtë apo një tjetër mënyrë u janë dhënë detyra të veçanta favorizuese për jetën.
Në tabelën periodike që nga hidrogjeni deri tek uraniumi, gjenden 92 elementë. (Elementet pas uraniumit nuk gjenden të lirë në natyrë por prodhohen në kushte laboratorike dhe nuk janë të qëndrueshëm.) 25 prej këtyre 92 elementeve, janë drejtpërdrejtë të domosdoshëm për jetën. 11 prej tyre janë elemente bazë që përbëjnë përafërsisht 99.9 % të organizmave të gjalla. Këto janë: hidrogjeni, karboni, oksigjeni, azoti, sodiumi, magnezi, fosfori, sulfuri, klori, potasiumi dhe kalciumi. 14 elementet e tjerë gjenden në sasira tepër të pakta nëpër organizmat e gjalla por që marrin përsipër funksione të rëndësishme, këto janë:
vanadiumi, kromi, mangani, hekuri, kobalti, nikeli, bakri, zinku, molibdeni, bori, silikoni, seleniumi, neoni dhe jodi. Përveç tyre edhe arseniku, kallai dhe tungsteni marrin pjesë në përbërjen e disa organizmave dhe kryejnë një mori funksionesh të pazgjidhura plotësisht. Tre elemente bromi, stronciumi dhe bariumi dihet që marrin pjesë në organizma të ndryshme por akoma nuk është zbuluar funksioni i tyre.97
 |
| Magnesium |
Ky spektër kaq i gjerë përfshin atome të grupeve të ndryshëm të tabelës periodike. (Në tabelë ndodhen grupe që i ndajnë atomet sipas vetive të tyre.) Në këtë gjendje shohim se atome që bëjnë pjesë në grupe të ndryshme në një farë mënyre që të gjithë përdoren për të mbështetur jetën. J. J. R. Frausto da Silva dhe R. J. P. Uilliams në librin e tyre me titull “The Biological Chemisrty of the Elements (Kimia Biologjike e Elementeve)” shkruajnë se:
"Elementet biologjike, duken sikur janë zgjedhur pikërisht nga çdo grup dhe nëngrup i tabelës periodike dhe çdo veti kimike e tyre, brenda kushteve të vendosura nga mjedisi, tregojnë se ndodhen në kontakt të vazhdueshëm me funksionet jetike".98
Elementet radioaktive që zenë vend në fund të tabelës periodike edhe pse në mënyrë indirekte, përsëri shërbejnë për jetën njerëzore. Ashtu siç tregohet me imtësi në librin "Nature's Destiny (Fati i Natyrës)" të Majkëll Dentonit, elementet radioaktive si uraniumi, kanë luajtur një rol të rëndësishëm në formimin e strukturës gjeologjike të tokës. Ka lidhje të ngushta gjithashtu me izolimin e nxehtësisë radioaktive në bërthamë të tokës duke penguar përhapjen e saj. Në saje të kësaj nxehtësie në bërthamë të tokës ka rezerva hekuri të lëngshëm duke mbrojtur në këtë mënyrë edhe fushën magnetike të tokës. Ato gaze inerte dhe metale të rralla tokësore të tabelës periodike, të cilat duken sikur nuk luajnë asnjë rol për jetën, janë shkallë të rëndësishme për zgjatimin e procesit të prodhimit të atomeve deri tek uraniumi.
Shkurtimisht të gjithë elementet që njohim, të cilat ndodhen në univers në një mënyrë apo tjetër janë në shërbim të jetës njerëzore. Asnjëri prej tyre nuk është kot dhe i paqëllimtë. Kjo nuk është asgjë tjetër veçse një demostrim i qartë i krijimit të universit nga Zoti posaçërisht për njeriun.
 |
Të gjithë ato veti fizike apo kimike të universit që shqyrtuam, arritëm në një përfundim se janë pikërisht siç duhet për të mundësuar ekzistencën e jetës. Sado që t’i shumojmë studimet tona, ky kriter i përgjithshëm nuk ndryshon. Në çdo pjesë të universit ekziston një qëllim dhe drejt këtij qëllimi një përshtatje, projektim dhe ekuilibër i përsosur.
Sigurisht që kjo situatë është një provë e ekzistencës së një Krijuesi të vetëm Suprem që e ka krijuar universin me këtë qëllim. Në çdo veti të lëndës që ana-lizuam, pamë fuqinë, inteligjencën dhe dijen e pafund të Zotit që e ka krijuar materien nga mosekzistenca. Çdo gjë përulet përpara vullnetit të Tij dhe rrjedhimisht gjithçka është brenda një harmonie të përsosur.
Shkenca e shekullit të 20-të, e cila ka arritur në këto përfundime, është argumentuese e fakteve, të cilat i janë deklaruar njerëzve në Kuran. Allahu në Kuran u drejtohet njerëzve në këtë mënyrë mbi çdo detaj të universit që nuk është gjë tjetër veçse demostrim i përsosmërisë së krijimit të Tij:
"I madhëruar është Ai që në dorën e fuqisë së Tij është i tërë sundimi dhe Ai ka fuqi mbi çdo send. Ai është që krijoi vdekjen dhe jetën, për t'ju sprovuar se cili prej jush është më vepërmirë. Ai është ngadhnjyesi, mëkatfalësi. Ai është që krijoi shtatë qiej palë mbi palë. Në krijimin e Mëshiruesit nuk mund të shohësh ndonjë kontrast (të metë), prandaj, drejto shikimin (përreth) se a sheh ndonjë çarje (boshllëk)? Pastaj, herë pas here drejto shikimin, e shikimi do të kthehet te ti i përulur dhe i molisur". (Mulk, 1-4)
84. "Science Finds God", Newsweek, 27 July 1998
85. Robert E. D. Clark, The Universe: Plan or Accident?, London, Paternoster Press, 1961, p. 98
86. Fred Hoyle, Religion and the Scientists, London: SCM, 1959; M. A. Corey, The Natural History of Creation, Maryland: University Press of America, 1995, p. 341
87. David Burnie, Life, Eyewitess Science, London: Dorling Kindersley, 1996, p. 8
88. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1. Oxford: Oxford University Press, 1950, p. 490
89. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1., p. 490
90. J. B. S. Haldane, "The Origin of Life", New Biology, 1954, vol. 16, p. 12
91. Michael Denton, Nature's Destiny, p. 115-116
92. Lawrence Henderson, The Fitness of the Environment, Boston: Beacon Press, 1958, p. 247-48
93. L. L. Ingraham, "Enzymic Activation of Oxygen", Comprehensive Biochemistry, (ed. M. Florkin, E. H. Stotz), Amsterdam: Elsevier, vol. 14, p. 424
94. The question of how the complicated enzyme system enabling oxygen intake by the respiratory system emerged is one of the questions the theory of evolution fails to explain. This system has an irreducible complexity, in other words, the system can not function unless all of its components function perfectly. For this reason, it is unlikely to say that the system developed from the simple form to the more complex, as evolution suggests. Prof. Ali Demirsoy, a biologist from Ankara Hacettepe University and a prominent advocate of the theory of evolution in Turkey, makes the following confession about this subject:
"However, there is a major problem here. Mitochondria use a fixed number of enzymes during the process of breaking (with oxygen). The absence of only one of these enzymes stops the functioning of the whole system. Besides, energy gain with oxygen does not seem to be a system which can proceed step by step. Only the complete system performs its function. That is why, instead of the step by step development to which we have adhered so far as a principle, we feel the urge to embrace the suggestion that, all the enzymes (Krebs enzyme) needed to perform the reactions of the mitochondria entered a cell all at once by coincidence or, were formed in that cell all at once. That is merely because those systems failing to use oxygen fully, in other words, those systems remaining in the intermediate level would disappear as soon as they react with oxygen." (Ali Demirsoy, The Basic Laws of Life: General Zoology, Volume 1, Section 1, Ankara, 1998, p.578)
While the probability of the formation of only one of the enzymes (special proteins) Prof. Demirsoy mentions above, saying "we have to accept that they formed all of a sudden by coincidence" is 1 over 10950, it is certainly unreasonable to put forward that many enzymes of that sort formed by coincidence
95. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1. Oxford: Oxford University Press, 1950, p. 490
96. Michael Denton, Nature's Destiny, p. 122-123
97. Irwin Fridovich, "Oxygen Radicals, Hydrogen Peroxide, and Oxygen Toxicity", Free Radicals in Biology, (ed. W. A. Pryor), New York: Academic Press, 1976, p. 239-240
98. J. J. R. Fraústo da Silva, R. J. P. Williams, The Biological Chemistry of the Elements, Oxford: Oxford University Press, p. 3-4
99. J. J. R. Fraústo da Silva, R. J. P. Williams, The Biological Chemistry of the Elements, p. 5