Bölüm 8: Yaşama Özel Elementler
Doğa kanunlarının gördüğümüz evreni yaratmak için ne denli olağanüstü bir şekilde ayarlandığını farkettiğinizde, evrenin öylesine oluşmadığını, arkasında bir amacın olması gerektiğini görüyorsunuz. John Polkinghorne, İngiliz fizikçi 84
 |
Şimdiye dek, içinde yaşadığımız evrenin tüm fiziksel dengelerinin bizim yaşamımız için özel olarak ayarlanmış olduğunu inceledik. Evrenin genel yapısının, Dünyamızın bu evren içindeki yerinin, yerkürenin fiziksel özelliklerinin, havanın, ışığın ve suyun, tam olarak bizim ihtiyaç duyduğumuz özelliklere sahip olduklarını gördük. Ancak bir de tüm bunların ötesinde, sahip olduğumuz bedeni oluşturan elementleri de incelememiz gerekir. Elimizi, gözlerimizi, saçımızı, ciğerlerimizi oluşturan ya da bize besin sağlayan tüm canlıları, bitkileri, havyanları, ağaçları, kuşları oluşturan elementler de, özel yaratılmış yapıtaşlarıdır.
Fizikçi Robert E. D. Clark'ın "Yaratıcı, yaşamın inşası için kullanılmak üzere özel parçalar yaratmıştır" şeklindeki sözüyle 85 ifade ettiği gibi, Allah, canlılığın yapıtaşlarını çok özel ve üstün birer tasarımla var etmiştir.
Bu yapıtaşlarının en önemlisi ise, karbondur.
Karbonun Yapısı

Karbon atomu doğada genellikle grafit halinde bulunur. Ancak bu kara madde, diğer atomlarla birleştiğinde ortaya olağanüstü derecede farklı maddeler çıkarır. Canlı bedenlerini oluşturan malzeme, karbonun diğer birkaç element ile kurduğu bu bağlardır.
Önceki bölümlerde, periyodik tabloda altıncı sırayı işgal eden karbonun, kırmızı dev adı verilen büyük yıldızların içinde ne denli olağanüstü bir süreç sonucunda üretildiğini incelemiştik. Karbonun bu olağanüstü oluşumunu keşfeden Fred Hoyle'un, "fizik kanunları, yıldızların içinde gerçekleştirdikleri sonuçlara bakılırsa, bilinçli olarak düzenlenmişlerdir" dediğini de görmüştük.86
Karbonu incelediğimizde bu atomun sadece oluşumunun değil, kimyasal özelliklerinin de düzenlendiğini görürüz.
Karbon doğada saf olarak iki ayrı formda bulur; grafit ya da elmas olarak. Ama yaptığı bileşikler ortaya çok farklı maddeler çıkarır. Hücre zarından ağaç kabuğuna, göz merceğinden bir geyiğin boynuzlarına, yumurta beyazından yılan zehirine kadar son derece farklı organik yapıların hepsi, karbon temelli bileşiklerden oluşur. Karbon, hidrojen, oksijen ve azot atomlarıyla çok farklı geometrik şekil ve sıralamalarda birleşerek, son derece farklı maddeler meydana getirir.
Karbon bileşiklerinin bazıları sadece birkaç atomdan oluşurken, bazılarında binlerce hatta milyonlarca atom vardır. Sadece karbon atomları bu denli uzun ve kalıcı bileşikler oluşturabilirler. David Burnie'nin Life adlı kitabında belirtildiği gibi, "karbon, çok olağandışı bir elementtir... Karbon ve onun bu olağandışı özellikleri olmasa, Dünya'da yaşam olması mümkün gözükmemektedir." 87
İngiliz kimyager Nevil Sidgwick, Chemical Elements and Their Compounds (Kimyasal Elementler ve Bileşikleri) başlıklı kitabında karbon hakkında şunları yazar:
Karbon, yapabildiği bileşiklerin sayısı ve çeşitliliği yönünden, diğer elementlerden tamamen farklı, özgün bir yapıdadır. Şimdiye dek karbonun yarım milyonun üzerinde farklı bileşiği ayrılmış ve tanımlanmıştır. Ama bu bile karbonun güçleri hakkında çok yetersiz bir bilgi verir, çünkü karbon tüm canlı maddelerin temelini oluşturur.88
Canlılığın karbon yerine bir başka elemente dayanması ise, fiziksel ve kimyasal özellikler nedeniyle, imkansızdır. Bir zamanlar karbona alternatif olarak ortaya atılan silikonun geçersiz bir aday olduğu ise anlaşılmış bulunmaktadır. Sidgwick, "yaşamın temeli olarak, silikonun karbonun yerini alacağı bir dünya düşüncesinin imkansız olduğundan artık emin olacak kadar bilgiye sahibiz" der. 89
Kovalent Bağlar
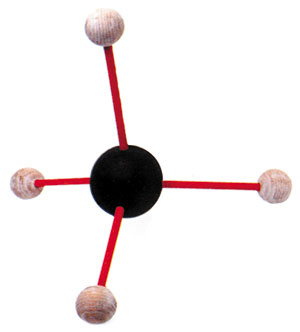 |
| Metan gazının yapısı: Ortadaki karbon atomunun etrafına dört ayrı hidrojen atomu bağlı. |
Karbon, organik bileşikleri oluşturmak üzere başka atomlarla birleştiğinde, atomlar arasında kurulan bağa "kovalent bağ" adı verilir. Kovalent bağ, iki atomun elektronlarını paylaşmaları ile kurulur.
Elektronlar atom çekirdeklerinin etrafında belirli yörüngeler içinde yer alırlar. Çekirdeğe en yakın yörüngede sadece iki elektron yer alabilir. Bir sonraki yörünge sekiz elektron alır. Daha sonraki 18 elektron alır ve böylece devam eder. İlginç olan, atomların, yörüngelerindeki elektron sayılarını tamamlamaya yönelik bir eğilimleri olmasıdır. Örneğin ikinci yörüngesinde 6 elektron bulunan oksijen, bu yörüngeye iki tane daha elektron ekleyerek sayıyı 8'e çıkarmak ister. Atomların neden böyle bir eğilimi olduğu sorusu cevaplanamamaktadır, ama bu eğilim olmasa, canlı organizmaların var olamayacağı açıktır.
Kovalent bağlar, atomların bu "yörünge tamamlama" isteği sayesinde kurulur. Her ikisi de yörüngelerini tamamlamak isteyen iki farklı atom, elektronlarını paylaşarak bu tamamlamayı gerçekleştirir. Örneğin suyu (H2O) oluşturan iki hidrojen ve bir oksijen atomu, kovalent bağ yaparlar. Oksijen, iki hidrojendeki birer elektronu paylaşarak ikinci yörüngesini 8'e tamamlamaktadır. Hidrojenlerin her biri de, oksijenin elektronlarından birer tanesini kullanarak kendi yörüngelerini ikiye tamamlamaktadırlar.
Karbon da işte bu tür kovalent bağlar kurarak çok farklı maddeler oluşturur. Metan, bunlardan bir tanesidir. Metanın oluşumu, dört ayrı hidrojen atomunun karbonla kovalent bağ yapmasıyla oluşur. Karbonun atom sayısı (6) oksijeninkinden (8) iki eksik olduğu için, karbon iki yerine dört hidrojenle bağ kurmaktadır.
Ancak karbonun kurduğu bağlar başta belirttiğimiz gibi çok geniş bir yelpaze oluşturur. Karbonun sadece hidrojen ile kurduğu farklı bağlar, "hidrokarbonlar" olarak bilinen büyük aileyi meydana getirir. Bu aile içinde; doğal gaz, sıvı petrol, gaz yağı, kerosen ve çeşitli makina yağları vardır. Etilen ve propilen olarak bilinen hidrokarbonlar ise petrokimya endüstrisinin temelidir. Başka hidrokarbonlar benzen, toluen ve turpentin gibi bileşikler meydana getirir. Giysilerimizi güvelenmekten koruması için dolaplara konan naftalin ise bir başka tür hidrokarbondur. Klor veya florla birleşen hidrokarbonlar ise anestezi maddeleri, yangın söndürücüler ve buzdolaplarında kullanılan freonlar gibi farklı maddeler oluştururlar.
 |
| Zeytinyağı, et ya da şeker gibi farklı maddeler, karbon, hidrojen, oksijen ya da azot atomlarının farklı tasarımlarda birleşmeleriyle oluşur. |
Karbonun hidrojen ve oksijenle yaptığı kovalent bağlar ise, bir başka geniş yelpaze oluşturur. Bunlar arasında etanol ve propanol gibi alkoller, aldehidler, ketonlar ve yağlı asitler vardır. Yine karbon, hidrojen ve oksijen bileşiklerinden oluşan çok önemli iki madde ise, yediğimiz besinlerin içindeki enerjiyi sağlayan glukoz ve fruktozdur. Ağacın sert maddesini ve kağıdın hammaddesini oluşturan selüloz, balmumu, sirke ve formik asit gibi maddelerin her biri, yine karbonun hidrojen ve oksijenle yaptığı kovalent bağlarla oluşur.
Karbon, hidrojen, oksijen ve azot atomları ile bağlar kurduğunda ise, bu kez ortaya yine çok önemli bileşikler çıkar. Bu bileşiklerin başında, vücudumuzun temel yapıtaşı olan proteinleri oluşturan amino asitler gelir. DNA'yı oluşturan nükleotidler de yine karbon, hidrojen, oksijen ve azot bileşiminden oluşan moleküllerdir.
Kısacası, karbon atomunun kurduğu kovalent bağlar, canlılığın var olabilmesi için mutlaka gereken şartlardan birisidir. Eğer karbon, oksijen, azot ve hidrojenle kovalent bağlar kuramayacak olsa, yaşamdan söz etmek de mümkün değildir.
Su ve Metan: Kovalent Bağlarin İki Farkli Örneği |
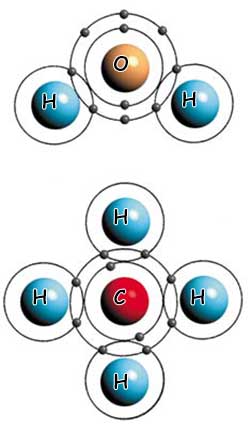 |
| Üstteki su molekülü, iki hidrojen ve bir oksijen atomu arasındaki kovalent bağla kurulmuştur. Alttaki metan molekülü ise, dört hidrojen atomunun bir karbon atomu ile kovalent bağ yapmasıyla oluşmuştur. |
Karbonun bu bağları kurabilmesini sağlayan şey ise, kimyacıların "metastabilite" dedikleri özelliğinden kaynaklanmaktadır. Ünlü biyokimyacı J. B. S. Haldane, bu özelliği şöyle açıklar:
Bir molekülün metastabil olması demek, bir dönüşüm sırasında serbest enerji açığa çıkarabilmesi, ama ısı, radyasyon ya da bir katalizörle birleşme durumları hariç istikrarlı olarak kalabilmesi demektedir.90
Bu teknik tanım, karbon atomunun çok özgün bir yapıya sahip olduğu anlamına gelmektedir. Bu özgün yapı sayesinde karbon normal şartlar altında çok kolay kovalent bağ kurabilmektedir.
Ancak burada çok ilginç bir nokta vardır. Karbonun yaşam için zorunlu olan söz konusu "metastabilite" özelliği, sadece çok dar bir ısı aralığı için geçerlidir. 100°C'nin üzerine çıkıldığında, karbon bileşikleri son derece kararsız hale gelir.
Bunu hepimiz günlük yaşamımızda gözlemleriz. Eti pişirirken yaptığımız şey, aslında karbon bileşiklerinin yapısını değiştirmektir. Ancak önemli bir noktaya dikkat etmek gerekir; pişen et, artık tamamen "ölü" hale gelir, yani canlı organizmalarda kullanılan yapısından farklılaşır. Nitekim çoğu karbon bileşikleri 100°C'nin üzerinde bozulurlar. Vitaminlerin büyük bölümü hemen parçalanır. Şekerler aynı şekilde yapı değişikliğine uğrar ve besin değerlerini yitirirler. Biraz daha yüksek bir ısıda, örneğin 150°C'de, karbon bileşikleri yanmaya başlar.
Yani karbon bileşiklerinin kovalent bağlar kurup bu bağları kararlı olarak koruyabilecekleri ısı aralığının üst sınırı, 100°C'yi aşmaz. Alt sınır ise 0°C civarındadır. 0°C'nin altındaki bir ısıda da organik biyokimyanın varlığı imkansızlaşır.
Ama diğer bileşikler böyle değildir. Organik olmayan maddelerin çoğu ısı değişimlerinden bu şekilde etkilenmezler. Bunu görmek için bir parça etin yanında, biraz metal, cam ya da taş koyup bu karışımı ısıtabilirsiniz. Isı arttıkça etin yapı değiştirdiğini, karardığını ve sonunda yandığını görürsünüz. Ama metale, cama ya da taşa, ısıyı yüzlerce derece daha artırsanız bile bir şey olmaz.
Dikkat ederseniz, karbon bileşiklerinin kovalent bağları kurmak ve korumak için ihtiyaç duydukları ısı aralığı, tam da Dünya üzerinde var olan ısı aralığıdır. Oysa daha önce de belirtmiş olduğumuz gibi, evrenin içindeki ısılar, en sıcak yıldızların içindeki milyarlarca derecelik sıcaklıklardan, "mutlak sıfır" noktası olan – 273.15°C'ye kadar değişebilmektedir. Ama insan için yaratılmış olan Dünya, tam da hayatın yapıtaşı olan karbon bileşiklerinin ihtiyaç duyduğu daracık ısı aralığına sahiptir.
Daha da dikkat çekici olan ise, aynı ısı aralığının suyun sıvı olduğu yegane ısı aralığı oluşudur. Bir önceki bölümde incelediğimiz gibi, yaşamın temel şartlarından biri olan su, tam da karbon bileşiklerinin ihtiyaç duyduğu ısıya ihtiyaç duymaktadır. Böyle bir uyumu zorunlu kılan bir doğa kanunu ise yoktur. Bu durum, suyun, karbonun ve Dünya'nın özelliklerinin birbirlerine uygun olarak yaratıldığının bir göstergesidir.
Zayıf Bağlar
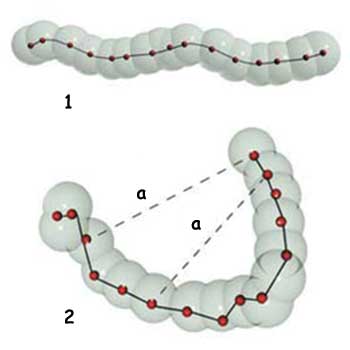 |
| 1. Kovalent bağ: Atomlar birbirleri ile sıkı sıkıya tutturulmuş. 2. Zayıf bağ: Atom zinciri farklı noktalardan birbirine üç boyutta tutturulmuş |
| a. Zayıf bağ |
Canlı bedenlerindeki atomları bir arada tutan yegane bağlar, kovalent bağlar değildir. Bir ikinci bağ sınıfı daha vardır. Farklı türleri olan bu bağların hepsine birden "zayıf bağlar" adı verilir.
Zayıf bağlar, kovalent bağlardan yaklaşık yirmi kat daha güçsüzdürler. Ama organik kimya için çok büyük bir öneme sahiptirler. Canlı bedenlerinin temel yapıtaşı olan proteinler, kompleks üç boyutlu formlarına zayıf bağlar sayesinde sahip olurlar.
Bunu açıklamak için proteinlerin yapısına değinmek gerekir. Proteinler genellikle "amino asit zincirleri" olarak bilinir. Bu doğru bir tanımdır, ancak yetersizdir. Çünkü "amino asit zinciri" tanımı, bir kolyedeki inci taneleri gibi art arda dizilmiş iki boyutlu bir diziyi çağrıştırmaktadır. Ama proteinleri oluşturan amino asitler, bir ağacın farklı dallarındaki yaprakların konumu gibi, üç boyutlu bir şekle sahiptirler.
Kovalent bağlar, aminoasitleri oluşturan atomları birarada tutarlar. Zayıf bağlar ise aminoasitleri gerekli üç boyutlu şekil içinde birleştirirler. Eğer zayıf bağlar olmasa, proteinlerin var olması imkansızdır. Proteinlerin olmadığı bir ortamda ise canlılıktan söz edilemez.
İşin ilginç yanı ise, zayıf bağların da ihtiyaç duydukları ısı aralığının, aynı kovalent bağlar gibi yine Dünya üzerinde var olan ısı aralığı oluşudur. Oysa zayıf bağlar ile kovalent bağların yapıları birbirinden tamamen farklıdır, aynı ısıya ihtiyaç duymalarını gerektirecek hiçbir doğal sebep yoktur. Buna rağmen her iki bağ sınıfı da, aynı ısı aralığı içinde kurulabilirler. Eğer kovalent bağlar ile zayıf bağlar farklı ısı aralıklarında kararlılık gösterselerdi, protein inşası yine imkansız hale gelirdi.
Karbon atomunun olağanüstü özelikleri ile ilgili olarak incelediğimiz tüm bu bilgiler, yaşamın temel malzemesi olan bu atom ile, yaşamın diğer temel malzemesi olan su ve yaşamın barınağı olan Dünya gezegeni arasında çok büyük bir uyum olduğunu göstermektedir. Michael Denton, Nature's Destiny (Doğanın Kaderi) adlı kitabında bu gerçeği şöyle vurgular:
Evrendeki dev ısı yelpazesi içinde, tek bir daracık ısı aralığı vardır ki; bu aralıkta 1) sıvı suya, 2) metastabilite özelliğine sahip çok bol ve farklı organik bileşiklere ve 3) kompleks moleküllerin üç boyutlu şekillerini kararlı kılan zayıf bağlara sahibiz.91
Bu daracık ısı aralığı ise, az önce belirttiğimiz gibi, bilinen bütün gök cisimleri arasında sadece Dünya'da vardır. Dahası, hayatın iki önemli temel taşı olan karbon ve su, Dünya'da son derece bol miktarlarda bulunmaktadır.
Tüm bunlar, karbon atomunun ve onun olağanüstü özelliklerinin yaşam için özel olarak yaratıldığını, Dünya gezegeninin ise karbon-temelli bir yaşam için özel olarak yaratıldığını göstermektedir.
Oksijenin Yapısı
Karbonun canlı bedenlerinin en önemli yapıtaşı olduğunu ve bu işlev için çok özel bir yapıyla yaratıldığını inceledik. Ama karbon temelli tüm canlıların varlığı, ikinci bir şarta daha bağlıdır; enerji. Enerji, yaşamın vazgeçilemez ihtiyacıdır.
Yeşil bitkiler enerjiyi Güneş ışığından alırlar. Ama hayvanlar ve bizim için enerjinin kaynağı "oksidasyon"; yani yanmadır. Bitkilerden aldığımız besinleri "yakarak" enerji elde ederiz. Yakma ise, oksidasyon teriminden anlaşıldığı gibi, oksitleyerek, yani oksijenle reaksiyona sokarak gerçekleşir. İşte bu nedenle oksijen de, kompleks yaşamın su ve karbon gibi temel bir şartıdır.
Bize enerji veren "yakma" reaksiyonunun formülü şudur:
karbon bileşikleri + oksijen > su + karbondioksit + enerji
Üstteki reaksiyon sonucunda, su ve karbondioksit yanında büyük miktarda enerji de açığa çıkar. Reaksiyonda belirtilen karbon bileşiklerinin başında, hidrojen ve karbon atomlarından oluşan hidrokarbonlar gelir. Örneğin glikoz (yani şeker), vücudumuzda sürekli olarak yakılarak enerji sağlanan temel bir hidrokarbondur.
İşin ilginç yanı, hidrokarbonları oluşturan hidrojen ve karbon atomlarının, oksidasyon için olabilecek en uygun atomlar olmalarıdır. Hidrojen, diğer tüm atomlar içinde, oksidasyona uğradığında en çok enerji açığa çıkaran atomdur. Bir başka deyişle oksijenin yakabileceği en iyi "yakıt"tır. Karbon ise "yakıt değeri" yönünden, hidrojen ve borondan sonra üçüncü sırada gelir. The Fitness of the Environment (Çevrenin Uygunluğu) kitabının yazarı Henderson, bu "olağanüstü derecede faydalı uyum" karşısında şaşkına düştüğünü belirtmiş ve şöyle yazmıştır:
"Fizyoloji için olabilecek en uygun sonuçları veren kimyasal reaksiyonlar, aynı zamanda yaşama en iyi enerji aktaran reaksiyonlardır."92
Ateşin Yapısı (Neden Bir Anda Yanmıyoruz?)
 |
Üstte incelediğimiz gibi, canlılara enerji sağlayan en temel reaksiyon, karbon ve hidrojen bileşiklerinin oksitlenmesi, yani yanmasıdır. Ancak bu noktada ilginç bir soru sorulabilir: Bizim vücudumuz da temelde karbon ve hidrojen bileşiklerinden oluşmaktadır. Peki neden vücudumuz da okside olmaz? Ya da daha açık bir ifadeyle, neden vücudumuz bir anda kibrit çöpü gibi tutuşup yanmaz?
Vücudumuzun oksijenle temas ettiği halde yanmaması, gerçekten şaşırılacak bir durumdur.
Bu şaşılacak durumun nedeni, oksijenin normal ısılardaki moleküler formu olan O2 molekülünün büyük ölçüde "asal", yani reaksiyona girmeyen bir yapıya sahip oluşudur. Ama bu durumda bir başka soru ortaya çıkar; madem O2 kolay kolay reaksiyona girmeyen bir moleküldür, o halde bu molekül bizim vücudumuzun içinde nasıl reaksiyona girmektedir?
19. yüzyıldan beri merak edilen bu sorunun cevabı, son yarım yüzyıl içindeki gelişmeler sonucunda anlaşılmıştır. Biyokimyasal gözlemler, insan vücudundaki bazı özel enzimlerin, sadece oksijenin atmosferde bulunan formu olan O2'yi reaksiyona sokmakla görevli olduğunu ortaya çıkarmıştır. Hücrelerimizdeki bu özel enzimler, son derece kompleks işlemler sonucunda, vücudumuzdaki demir ve bakır atomlarını katalizör (hızlandırıcı) olarak kullanmakta ve böylece oksijeni reaktif hale getirmektedirler. 93
Yani ortada çok ilginç bir durum vardır: Oksijen yakıcı bir elementtir ve normalde bizim bedenimizi de yakması beklenmelidir. Bunu engellemek için, oksijenin atmosferdeki formu olan O2 ilginç bir biçimde "asal" kılınmıştır, yani kolay kolay reaksiyona girmemektedir. Ama bedenimizin enerji elde etmesi için de, oksijenin yakıcılığına ihtiyacı vardır. Onun için hücrelerimizin içine, bu asal gazı son derece reaktif hale getiren kompleks bir enzim sistemi yerleştirilmiştir.
Bu arada yeri gelmişken belirtmek gerekir ki, söz konusu enzim sistemi, canlılığın rastlantılarla oluştuğunu iddia eden evrim teorisinin asla açıklayamadığı bir tasarım harikasıdır.94
Bedenimizin aniden tutuşmasını engellemek için alınmış bir başka tedbir daha vardır. Bu, İngiliz kimyager Nevil Sidgwick'in ifadesiyle "karbonun karakteristik asallığı"dır.95Bir başka deyişle, karbon atomu da normal ısılarda kolay kolay oksijenle reaksiyona girmez. Kimyasal dille ifade edilen bu özelliği, aslında hepimiz günlük hayatta çok yakından yaşamışızdır. Soğuk bir havada odun ya da kömür kullanarak ateş yakmaya çalıştığımızda yaşadığımız zorluk, karbonun söz konusu "karakteristik asallığı"dır. Ateşi yakabilmek için bir hayli uğraşmamız, odunun ya da kömürün ısısını iyice yükseltmemiz gerekir. Ama ateş bir kez alev aldıktan sonra da, karbon hızla reaksiyona girer ve büyük bir enerji açığa çıkar. Bu yüzden bir yangını başlatmak (kibrit vs. gibi özel ateş kaynakları olmadıkça) son derece zordur. Ama yangın bir kez başladıktan sonra da çok büyük bir ısı oluşur ve bu ısı etraftaki diğer karbon bileşiklerini de tutuşturur
Bu durum incelendiğinde, aslında ateştin de çok özel bir yapı olduğu görülür. Oksijenin ve karbonun kimyasal özellikleri öyle ayarlanmıştır ki, bunlar sadece çok yüksek bir ısıda reaksiyona girip ateş oluştururlar. Eğer böyle olmasaydı, Dünya üzerindeki yaşam imkansız hale gelirdi. Eğer oksijenin ve karbonun reaksiyona girme eğilimleri biraz daha fazla olsaydı, hava sıcaklığı biraz arttığında insanların, ağaçların, hayvanların bir anda tutuşup yanmaları sıradan bir vaka haline gelirdi. Örneğin çölde yürüyen bir insan, sıcaklık gün ortasında en yüksek dereceye çıktığı anda, bir kibrit çöpü gibi bir anda alevlere boğulabilirdi. Bitkiler ve hayvanlar da aynı tehlikeyle yüzyüze kalırdı. Elbette böyle bir Dünya'da yaşamdan söz etmek imkansız olurdu.
Eğer oksijenin ve karbonun karakteristik asallıkları daha fazla olsaydı, bu sefer de Dünya üzerinde ateş yakmak çok zor, belki de imkansız hale gelirdi. Ateşin olmadığı bir ortamda ise, insanların ısınması ve teknoloji geliştirmesi mümkün olamazdı. Çünkü bilindiği gibi teknoloji metallere dayanır ve metaller de ancak çok yüksek ısılarda yumuşayıp şekillendirilebilirler.
Bu durum, karbon ve oksijenin kimyasal özelliklerinin de yine insan yaşamı için en uygun biçimde olduğunu göstermektedir. Michael Denton, bu konuda şunları yazar:
Karbon ve oksijen atomlarının normal ısılarda gösterdikleri reaksiyona girmeme eğilimi, bir kez reaksiyona girdiklerinde açığa çıkan dev boyuttaki enerjiyle birlikte, Dünya üzerindeki yaşam açısından çok önemli ayarlamalardır. Kompleks canlıların kontrollü ve düzgün bir biçimde enerji edinmelerini ve aynı zamanda insanlığın ateşi kontrollü bir biçimde kullanarak teknoloji için gerekli ısıları elde etmesini sağlayan şey, işte karbon ve oksijendeki bu ilginç ayarlamadır.96
Bir başka deyişle, karbon da oksijen de, bizim yaşamımıza en uygun olacak biçimde yaratılmışlardır. Bu iki elementin özellikleri, bizlere ateş yakabilme ve bu ateşi en uygun biçimde kullanma imkanı vermektedir. Dahası, Dünya'nın her bir yanı, çok bol miktarda karbon içeren, dolayısıyla ateş yakmak için kolaylıkla kullanabildiğimiz ağaçlarla doldurulmuştur. Tüm bunlar, ateşin ve malzemelerinin de insan yaşamına en uygun biçimde yaratıldığını göstermektedir. Nitekim Allah Kuran'da şöyle buyurmuştur:
Ki O (Allah), size yeşil ağaçtan bir ateş kılandır; siz de ondan yakıyorsunuz. (Yasin Suresi, 80)
Oksijenin İdeal Çözünürlüğü
Vücudumuzun oksijeni kullanabilmesi, bu gazın suyun içinde çözünebilirlik özelliğinden kaynaklanır. Nefes aldığımızda ciğerlerimize giren oksijen, hemen çözünerek kana karışır. Kandaki hemoglobin adlı protein çözünmüş olan bu oksijen moleküllerini yakalayarak hücrelere taşır. Hücrelerde ise, az önce belirttiğimiz özel enzim sistemleri sayesinde, bu oksijen kullanılarak ATP adı verilen karbon bileşikleri yakılır ve enerji elde edilir.
Tüm kompleks canlılar bu sistemle enerjiye ulaşırlar. Ama elbette bu sistemin işleyebilmesi, öncelikle oksijenin çözünürlük özelliğine bağlıdır. Eğer oksijen yeterli derecede çözünür olmasa, kana çok az miktarda oksijen girecek ve bu da hücrelerin enerji ihtiyacının karşılanmasına yetmeyecekti. Oksijenin fazla çözünmesi ise, kandaki oksijen oranını aşırı derecede artıracak ve "oksidasyon zehirlenmesi" meydana getirecektir.
Konunun dikkat çeken yönü ise, farklı gazların su içinde çözünebilirlik oranlarının, birbirlerinden bir milyon kat farklı olabilmesidir. Yani en çok çözünen gaz ile en az çözünen gaz arasında, bir milyon katlık bir çözünebilirlik farkı vardır. Hemen hemen hiçbir gazın da çözünebilirlik oranı aynı değildir. Örneğin karbondioksit, oksijene göre su içinde yirmi kat daha fazla çözünür. Bu kadar farklı çözünebilirlik değerleri içinde oksijenin sahip olduğu değer ise tam bizim için uygun olan değerdir.
Oksijenin çözünürlüğü acaba biraz daha az ya da fazla olsa ne olurdu?
Önce birinci ihtimale bakalım. Eğer oksijen suyun (ve dolayısıyla kanın) içinde biraz daha az çözünecek olsa, kana daha az oksijen karışacak ve hücreler yeterince oksijen alamayacaktır. Bu durumda insan gibi yüksek metabolizmalı canlıların yaşaması çok zorlaşacaktır. Böyle bir durumda ne kadar çok nefes alırsak alalım, havadaki oksijen hücrelere yeterince ulaşmadığı için, kademeli bir biçimde boğulma tehlikesi ile karşı karşıya kalırız.
Eğer oksijenin çözünürlüğü daha fazla olursa, bu kez az önce belirttiğimiz "oksidasyon zehirlenmesi" ortaya çıkar. Oksijen aslında çok tehlikeli bir gazdır ve normal sınırların üstünde alındığında canlılar için öldürücü bir etkiye sahiptir. Kanda oksijen oranı arttığında, bu oksijen su ile reaksiyona girerek son derece reaktif ve tahrip edici yan ürünler ortaya çıkarır. Vücutta, oksijenin bu etkisini gideren son derece kompleks enzim sistemleri vardır. Ama eğer oksijen oranı biraz daha fazlalaşsa, bu enzim sistemleri işe yaramayacak ve aldığımız her nefes vücudu biraz daha zehirleyerek bizi kısa sürede ölüme sürükleyecektir. Kimyacı Irwin Fridovich, bu konuda şöyle der:
Solunum yapan bütün organizmalar ilginç bir tuzağa yakalanmış durumdadırlar. Yaşamlarını destekleyen oksijen, aynı zamanda onlar için zehirleyici (toksik) özelliktedir ve bu tehlikeden sadece çok hassas bazı özel savunma mekanizmaları sayesinde korunurlar.97
İşte bizi söz konusu tuzaktan, yani oksijenle zehirlenme ya da oksijensiz kalarak boğulma tehlikelerinden koruyan şey, oksijenin çözünürlük oranının ve vücuttaki kompleks enzim sistemlerinin tam gerektiği biçimde belirlenmiş ve yaratılmış olmasıdır. Daha açık bir ifadeyle, Allah, soluduğumuz havayı da, bu havayı kullanmamızı sağlayan sistemlerimizi de kusursuz bir uyumla yaratmıştır.
Diğer Elementler
 |
| Bakır |
Kuşkusuz yaşam için özel olarak yaratılmış elementler karbon ve oksijenle sınırlı değildir. Canlı bedenlerinin yine büyük kısmını oluşturan hidrojen, azot gibi elementler de canlı yaşamına imkan verecek belirli özelliklere sahiptir. Bunun dışında, periyodik tabloda bulunan tüm elementlere, aslında şu ya da bu şekilde,
Periyodik tabloda hidrojenden uranyuma kadar 92 tane element bulunur. (Uranyum sonrası elementler doğada bulunmazlar, çağımızda laboratuvarda üretilmektedirler ve zaten kararlı değildirler.) Bu 92 elementin 25 tanesi, yaşam için doğrudan gereklidir. Bunların 11 tanesi, yani; hidrojen, karbon, oksijen, azot, sodyum, magnezyum, fosfor, kükürt, klor, potasyum ve kalsiyum, canlı organizmaların yaklaşık % 99.9'unu oluşturan temel elementlerdir. Bunların dışındaki 14 element, yani; vanadyum, krom, mangan, demir, kobalt, nikel, bakır, çinko, molibden, bor, silikon, selenyum, flor ve iyot ise canlı bedenlerinde çok az miktarda bulunur, ama önemli işlevler üstlenirler. Bunların dışında arsenik, kalay ve tungsten de bazı organizmalarda yer alır ve bir kısmı tam çözülememiş işlevler yürütürler. Brom, stronsiyum ve baryum gibi üç elementin daha canlı organizmaların çoğunda bulunduğu bilinmektedir ama işlevleri henüz anlaşılamamıştır.98
 |
| Magnezyum |
Bu geniş yelpaze, periyodik tablonun farklı gruplarına bağlı atomları içermektedir. (Periyodik tabloda atomları özelliklerine göre ayıran gruplar vardır.) Bu durum ise, periyodik tablodaki farklı element gruplarının hepsinin bir şekilde yaşam için kullanıldığını göstermektedir. J. J. R. Fraústo da Silva ve R. J. P. Williams, The Biological Chemistry of the Elements (Elementlerin Biyolojik Kimyası) adlı kitaplarında şöyle yazarlar:
Biyolojik elementler, periyodik tablonun her grubundan ve alt grubundan özenle seçilmiş gibi görünmektedirler ve bu da her türlü kimyasal özelliğin, çevre şartlarının koyduğu sınırlar içinde, yaşam işlevleriyle ilişkili olduğunu göstermektedir.99
Periyodik tablonun en sonunda yer alan radyoaktif elementler ise daha dolaylı da olsa, yine insan yaşamına hizmet ederler. Michael Denton'ın Nature's Destiny (Doğanın Kaderi) adlı kitabında ayrıntılı olarak anlattığı gibi, söz konusu radyoaktif elementler, örneğin uranyum, Dünya'nın jeolojik yapısının şekillenmesinde büyük rol oynamışlardır. Dünya'nın çekirdeğindeki ısının saklanmasının radyoaktivite ile yakından ilişkisi vardır. Bu ısı sayesinde Dünya'nın çekirdeğinde sıvı demir birikimi vardır ve Dünya'nın manyetik alanı bu sayede korunmaktadır. Periyodik tablo içinde yaşam için etkisiz gibi görünen asal gazlar ve nadir toprak metalleri ise, atom üretme işleminin uranyuma kadar uzanabilmesi için geçilmesi gereken zorunlu basamaklardır.100
Kısacası evrende var olduğunu bildiğimiz tüm elementler, insan yaşamına bir şekilde hizmet etmektedirler. Hiçbiri boşuna ve amaçsız değildir. Bu durum, evrenin Allah tarafından insan için yaratıldığını ortaya koyan bir başka delildir.
 |
Sonuç
Evrenin incelenen her fiziksel ya da kimyasal özelliği, yaşam için tam olması gerektiği gibi çıkmaktadır. İnceleme ne kadar artırılırsa artırılsın bu genel kural değişmemektedir. Evrenin her parçasında insan yaşamını gözeten bir amaç ve bu amaca yönelik kusursuz bir uyum, düzen ve denge vardır.
Ve elbette bu durum, evreni bu amaçla yaratmış olan üstün bir Yaratıcı'nın varlığının ispatıdır. Maddenin hangi özelliğini incelersek inceleyelim, maddeyi yoktan yaratmış olan Allah'ın sonsuz bilgi, akıl ve kudretini görürüz. Her şey O'nun iradesine boyun eğmiştir ve dolayısıyla her şey kusursuz bir uyum içindedir.
20. yy biliminin varmış olduğu bu sonuç ise, yine, insanlara Kuran'da bildirilmiş olan bir gerçeğin teyididir. Allah, evrenin her detayının Kendi yaratışının mükemmelliğini gösterdiğini, Kuran'da insanlara şu şekilde bildirmiştir:
Mülk elinde bulunan (Allah) ne yücedir. O, herşeye güç yetirendir. O, amel (davranış ve eylem) bakımından hanginizin daha iyi (ve güzel) olacağını denemek için ölümü ve hayatı yarattı. O, üstün ve güçlü olandır, çok bağışlayandır. O, biri diğeriyle 'tam bir uyum’ (mutabakat) içinde yedi gök yaratmış olandır. Rahman (olan Allah)ın yaratmasında hiçbir 'çelişki ve uygunsuzluk’ (tefavüt) göremezsin. İşte gözü(nü) çevirip-gezdir; herhangi bir çatlaklık (bozukluk ve çarpıklık) görüyor musun? Sonra gözünü iki kere daha çevirip-gezdir; o göz (uyumsuzluk bulmaktan) umudunu kesmiş bir halde bitkin olarak sana dönecektir. (Mülk Suresi, 1-4)
Dipnotlar
84. "Science Finds God", Newsweek, 27 Temmuz 1998
85. Robert E. D. Clark, The Universe: Plan or Accident?, London, Paternoster Press, 1961, s. 98
86. Fred Hoyle, Religion and the Scientists, London: SCM, 1959; M. A. Corey, The Natural History of Creation, Maryland: University Press of America, 1995, s. 341
87. David Burnie, Life, Eyewitess Science, London: Dorling Kindersley, 1996, s. 8
88. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1. Oxford: Oxford University Press, 1950, s. 490
89. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1., s. 490
90. J. B. S. Haldane, "The Origin of Life", New Biology, 1954, vol. 16, s. 12
91. Michael Denton, Nature's Destiny, s. 115-116
92. Lawrence Henderson, The Fitness of the Environment, Boston: Beacon Press, 1958, s. 247-48
93. L. L. Ingraham, "Enzymic Activation of Oxygen", Comprehensive Biochemistry, (ed. M. Florkin, E. H. Stotz), Amsterdam: Elsevier, vol. 14, s. 424
94. Oksijen solunumunu sağlayan kompleks enzim sisteminin nasıl ortaya çıktığı sorusu, evrim teorisinin açıklayamadığı sayısız sorulardan biridir. Bu enzim sisteminin özelliği, ancak eksiksiz çalışması halinde işe yaramasıdır, dolayısıyla daha basite indirgenemez. Bu nedenle de evrimin iddia ettiği gibi basitten karmaşığa doğru bir gelişim izlediği öne sürülemez. Türkiye'nin en önde gelen evrim savunucularının başında gelen Hacettepe Üniversitesi biyoloğu Prof. Ali Demirsoy, bu konuda şu itirafı yapmaktadır:
"Yalnız, burada henüz çözülemeyen bir sorun vardır. Mitokondriler bu (oksijenli) parçalamaları gerçekleştirirken belirli sayıda enzim kullanırlar. Bu enzimlerin bir tanesinin eksikliği tüm sistemin durmasına neden olur. Ayrıca oksijenli enerji kazanımı, kademe kademe gelişecek bir sistem olarak da görünmemektedir. Tümü, ancak bir işlev sistemi oluşturur. Bu nedenle buraya kadar ilke olarak savunduğumuz kademe kademe gelişme yerine, ister istemez, çok az bir olasılık da olsa, mitokondrilerin oksijenli tepkimelerini yürütecek tüm enzimlerin (Krebs enzimleri) bir defada, bir rastlantı sonucu bir hücreye girdiğini ya da bir defada o hücre içinde oluştuğunu kabul etmek zorundayız. Çünkü oksijeni tam olarak kullanamayan, yani ara kademede kalan tüm sistemler, oksijenle temas edince yok olacaktı. (Ali Demirsoy, Yaşamın Temel Kuralları: Genel Biyoloji, Genel Zooloji, cilt 1, kısım 1, Ankara, 1998, s. 578)
Ali Demirsoy'un "hepsinin bir anda tesadüfen oluştuğunu kabul etmek zorundayız"dediği enzimlerin (özel proteinlerin) tek birinin tesadüfen oluşma şansı bile 10950'de 1'lik ihtimallerde iken, yani imkansızken, bu tip çok sayıda enzimin tesadüfen oluştuğunu öne sürmek, elbette ki akıl dışıdır.
95. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1. Oxford: Oxford University Press, 1950, s. 490
96. Michael Denton, Nature's Destiny, s. 122-123
97. Irwin Fridovich, "Oxygen Radicals, Hydrogen Peroxide, and Oxygen Toxicity", Free Radicals in Biology, (ed. W. A. Pryor), New York: Academic Press, 1976, s. 239-240
98. J. J. R. Fraústo da Silva, R. J. P. Williams, The Biological Chemistry of the Elements, Oxford: Oxford University Press, s. 3-4
99. J. J. R. Fraústo da Silva, R. J. P. Williams, The Biological Chemistry of the Elements, s. 5
