Sizce çevrenizde gördüğünüz cisimleri birbirinden farklı kılan şey nedir? Renklerini, biçimlerini, kokularını, tatlarını birbirinden farklılaştıran nedir? Neden bir madde yumuşakken diğeri sert, bir diğeri akışkandır? Buraya kadar okuduklarınızdan hareket ederek bu sorulara "atomların farklılığıdır" diye cevap verebilirsiniz. Ancak bu cevap yeterli değildir. Çünkü eğer bu farklılıkların sebebi atomlar olsaydı, o zaman birbirinden farklı özellikler taşıyan milyarlarca atom olması gerekirdi. Ama gerçekte bu böyle değildir. Birçok madde aynı atomları içermesine rağmen farklı görünür ve farklı özellikler taşır. Bunun da nedeni atomların molekülleri oluşturmak için aralarında kurdukları farklı kimyasal bağlardır.
Maddeye giden ilk basamak olan atomlardan sonra ikinci basamak moleküllerdir. Moleküller, maddenin kimyasal özelliklerini belirten en küçük birimlerdir. Bu küçük yapılar iki veya daha çok atomdan, bazıları da binlerce atom grubundan oluşur. Atomları, molekül içinde elektromanyetik çekim kuvvetine dayalı kimyasal bağlar bir arada tutarlar. Yani bu bağlar atomların sahip oldukları elektrik yüklerini esas alarak kurulurlar. Atomların elektrik yükleri de daha önce belirttiğimiz gibi son yörüngelerinde taşıdıkları elektronlar tarafından belirlenir. Moleküllerin çeşitli biçimlerde bir araya gelmeleriyle de çevremizde gördüğümüz madde çeşitliliği ortaya çıkar. Bu noktada da maddenin çeşitliliğinin ana merkezinde yer alan kimyasal bağların önemi anlaşılır.
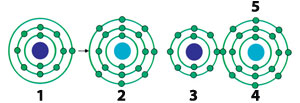 |
| 1) Na-Sodyum Atomu |
| Sodyum atomu son yörüngesindeki elektronu klor atomuna vererek, pozitif yüklenir. Elektronu alan klor ise negatif yük sahibi olur. Bu iki yükün birbirini çekmesinin sonucunda da aralarında iyonik bağ oluşur.25 |
Yukarıda da belirtildiği gibi kimyasal bağlar, atomların dış yörüngelerindeki elektronların hareketleriyle oluşur. Her atom en dışta yer alan yörüngesini, alabileceği en fazla elektron sayısına tamamlama gayreti içindedir. Atomların son yörüngelerinde bulundurabilecekleri maksimum elektron sayısı 8’dir. Bunu sağlarken atomlar ya en dış yörüngelerindeki elektronları 8’e tamamlamak için başka atomlardan elektron alırlar, ya da eğer en dış yörüngelerinde az sayıda elektron varsa, bunları bir başka atoma vererek önceden tamamlanmış olan bir alt yörüngeyi en dış yörüngeleri haline getirirler. Atomların kendi aralarında yaptıkları bu elektron alıp verme eğilimi, birbirleri arasında yaptıkları kimyasal bağların temel itici gücünü oluşturur.
Bu itici güç, yani atomların son yörüngelerindeki elektron sayılarını maksimuma tamamlama amaçları, bir atomun diğer atomlarla 3 çeşit bağ kurabilmesini sağlar. Bunlar iyonik bağ, kovalent bağ ve metalik bağdır.
Moleküller arasında ise genel olarak "zayıf bağlar" başlığı altında toplanan özel bağlar görev yapar. Bu bağlar atomların molekülleri oluşturmak üzere kurdukları bağlardan daha zayıftır. Çünkü moleküllerin maddeyi meydana getirmek için daha esnek yapılara ihtiyaçları vardır.
Bu bağların özellikleri nedir ve nasıl kurulurlar, kısaca ele alalım.
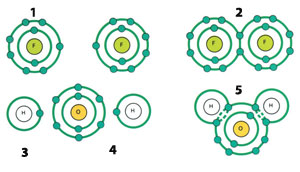 | |
| 1) Flor atomu | 4) Oksijen Atomu |
| Bazı atomlar son yörüngelerindeki elektronları ortak kullanarak kovalent bağ ile yeni moleküller oluştururlar. | |
Bu bağ ile birleşen atomlar son yörüngelerindeki elektron sayısını 8’e tamamlamak için birbirleriyle elektron alışverişinde bulunurlar. Son yörüngelerinde 4’e kadar elektronu bulunan atomlar bu elektronları birleşecekleri yani bağ kuracakları atoma verirler. Son yörüngelerinde 4’den fazla elektron bulunduran atomlar ise birleşecekleri yani bağ kuracakları atomlardan elektron alırlar. Bu tip bağ ile oluşan moleküller kristal (kübik) yapıya sahip olurlar. Yakından tanıdığımız sofra tuzu (NaCl) molekülleri bu bağ ile oluşmuş maddelerden biridir. Peki atomların neden böyle bir eğilimi vardır? Bu eğilim olmasa ne olurdu?
Bugüne kadar atomların bir araya gelmek için aralarında kurdukları bağlar çok genel biçimde tarif edilebilmiştir. Ama atomların neden böyle bir prensiple davrandıkları anlaşılamamıştır. Yoksa atomlar son yörüngelerindeki elektronların sayısının 8 olması gerektiğini kendileri mi tespit etmiştir? Tabii ki hayır. Bu öyle büyük bir tespittir ki, bir aklı, iradesi ve şuuru olmayan bir atomun kendisini aşmaktadır. Çünkü bu sayı maddenin ve dolayısıyla evrenin meydana gelmesi için ilk basamak olan atomların birleşmelerindeki kilit noktadır. Eğer atomların bu prensipten kaynaklanan eğilimleri olmasaydı hayatımız için gerekli olan bazı moleküller oluşamazdı.
Oysa atomlar ilk yaratıldıkları andan itibaren sahip oldukları bu eğilim sayesinde moleküllerin ve maddenin kusursuz bir biçimde meydana gelmesi için hizmet ederler.
Atomların arasındaki bağları inceleyen bilim adamları ilginç bir durumla karşılaştılar. Bazı atomlar bağ kurmak için elektron alışverişinde bulunurken, bazıları da son yörüngelerindeki elektronları ortak kullanmaktaydılar. Daha sonra yapılan çalışmalar da canlılık için vazgeçilmez önem taşıyan birçok molekülün bu bağlar sayesinde var olabildiğini ortaya koymuştur.
Kovalent bağın daha iyi anlaşılabilmesi için kolay bir örnek verelim: Daha önce elektron yörüngelerinden bahsederken de belirttiğimiz gibi atomların ilk yörüngelerinde en fazla 2 elektron taşınabilir. Hidrojen atomu tek bir elektrona sahiptir ve elektron sayısını 2’ye çıkarıp kararlı bir atom olma eğilimindedir. Bu yüzden hidrojen atomu 2. bir hidrojen atomuyla kovalent bağ yapar. Yani, 2 hidrojen atomu da birbirlerinin tek elektronlarını 2. elektron olarak kullanır. Böylece H2 molekülü oluşur.26
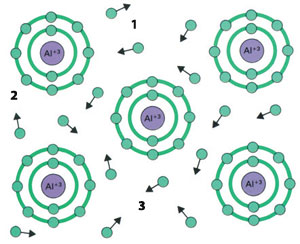 | 1) Elektron Metal atomları arasında farklı bir kimyasal bağ söz konusudur. Her metal atomu kendi dış elektronunu genel bir havuza koyar. Bu elektronlar denizi, metallerin iletkenliğinin nedenidir.27 |
Eğer çok sayıda atom, birbirlerinin elektronlarını ortaklaşa kullanarak birleşiyorlarsa, bu kez "metalik bağ" söz konusudur. Günlük hayatta çevremizde gördüğümüz ya da kullandığımız pek çok araç ve gerecin ana maddesini oluşturan demir, bakır, çinko, alüminyum, vs. gibi metaller, kendilerini oluşturan atomların birbirleri aralarında metalik bağlar yapmaları sonucunda, elle tutulur, gözle görülür, kullanılabilir bir yapı kazanmışlardır.
Atomların yörüngelerindeki elektronların neden böyle bir eğilimi olduğu sorusunu ise bilim adamları cevaplayamamaktadır. Fakat canlı organizmalar ancak nedenini bilmediğimiz bu eğilim sayesinde var olabilirler.
Acaba tüm bu bağlarla kaç farklı bileşik oluşabilmektedir?
Bileşik, birden fazla atomun belirli oranlarda kimyasal reaksiyonu sonucu biraraya gelmesiyle oluşan saf maddeye denir. Bileşiklerin en küçük yapıtaşı moleküllerdir.
Laboratuvarlarda her gün yeni bileşikler oluşturulmaktadır. Şu an için yaklaşık 2 milyon bileşikten bahsetmek mümkündür. En basit kimyasal bileşik, hidrojen molekülü kadar ufak olabildiği gibi, milyonlarca atomdan oluşan bileşikler de vardır.28
Bir element acaba en fazla kaç değişik bileşik oluşturabilir? Bu sorunun cevabı oldukça ilginçtir. Çünkü bir tarafta hiçbir elementle birleşmeyen bazı elementler (soy gazlar) vardır. Diğer tarafta ise 1.700.000 bileşik oluşturabilen karbon atomu vardır. Toplam bileşik sayısının 2 milyon kadar olduğunu tekrar hatırlarsak, 109 elementin 108’i toplam 300.000 bileşik yapmaktadırlar. Ancak karbon olağanüstü bir şekilde tek başına tam 1.700.000 bileşik yapabilmektedir.
 | |||
| 1) atmosfer | 5) Mg 1.9% | 9) K 2.4% | 13 ) Al 7.6% |
| Evrenin Hammaddeleri ve Periyodik Cetvel: Doğada bulunan 92 adet ve laboratuvarlarda oluşturulan 17 adet farklı element “Periyodik Cetvel” diye adlandırılan bir tabloda, proton sayılarına göre yerleştirilmişlerdir. İlk bakışta; Periyodik tablo birer, ikişer harfli alt ve üst köşelerinde rakamlar yazan kutucuklardan ibaret gibi gözükebilir. Ama, bu tabloya, şu an solumakta olduğumuz hava ve bedenimiz dahil tüm evren sığmaktadır. | |||
 |
| Karbon atomu |
Karbon, canlılar için en hayati elementtir. Çünkü bütün canlı maddeler karbon bileşiklerinden oluşmuşlardır. Bizlerin varlığı için bu kadar önemli olan karbon atomunun özelliklerini sayfalarca yazsak bitiremeyiz, nitekim kimya bilimi de henüz bu özelliklerin tümünü keşfedebilmiş değildir. Biz burada karbonun sadece çok önemli birkaç özelliğinden bahsedeceğiz.
Hücre zarından ağaç kabuğuna, göz merceğinden bir geyiğin boynuzlarına, yumurta beyazından yılan zehirine kadar son derece farklı organik yapıların hepsi, karbon temelli bileşiklerden oluşur. Karbon, hidrojen, oksijen ve azot atomlarıyla çok farklı geometrik şekil ve sıralamalarda birleşerek, son derece farklı maddeler meydana getirir. Peki ama karbonun yaklaşık olarak 1.7 milyon kadar bileşik yapabilmesinin sebebi nedir?
Karbonun en önemli özelliklerinden birisi, birbiri ardınca dizilerek çok kolay zincir oluşturabilmesidir. En kısa karbon zinciri 2 karbon atomundan oluşur. En uzun zincirin kaç karbon atomundan oluştuğu konusunda ise kesin bir rakam verilememekle birlikte, yaklaşık olarak 70 halkalı bir zincirden bahsedilebilir. Karbon atomundan sonra en uzun zincir oluşturabilen atomun, 6 halka ile silisyum atomu olduğunu düşünürsek, karbon atomundaki olağanüstü durum daha iyi fark edilebilir.29
Karbonun bu kadar çok halkalı zincir yapabilmesinin sebebi, zincirlerinin sadece düz çizgi şeklinde olmamasıdır. Zincirler dallar halinde de olabilirler, çokgenler de oluşturabilirler.
Bu noktada, zincirin şeklinin önemi çok büyüktür. İki karbon bileşiğinde, karbon atomu sayısı aynı fakat bileşiklerin zincir biçimleri farklıysa, ortaya 2 ayrı madde çıkmaktadır. Ve böylece karbon atomunun, yukarıda saydığımız özellikleri ile, canlı hayatı için çok büyük önemi olan moleküller yaratılmaktadır.
Karbon bileşiklerinin bazıları sadece birkaç atomdan oluşur. Bazıları ise binlerce hatta milyonlarca atomdan meydana gelir. Bütün elementler içinde sadece karbon elementinin atomları bu denli uzun ve kalıcı bileşikler oluşturabilir. Ünlü kimyager David Burnie Life adlı kitabında bu elementin özelliğini şöyle ifade eder:
"Karbon, çok olağan dışı bir elementtir... Karbon ve onun bu olağan dışı özellikleri olmasa, Dünya'da yaşam olması mümkün gözükmemektedir." 30
ÜÇ BENZER MOLEKÜL SONUÇ: Üç Çok Farklı Madde |
| Moleküller arasındaki birkaç atomluk bir farklılık bile, çok değişik sonuçlar oluşturur. Örneğin şimdi vereceğimiz iki moleküle dikkatle bir bakın. İkisi de birbirine çok benziyor, ancak karbon ve hidrojen sayılarında çok ufak farklılıklar var. Ama sonuç iki zıt madde oluşturmaya yetiyor: C18H24O2 ve C19H28O2 Bu moleküller nedir, bir tahminde bulunabiliyor musunuz? Hemen söyleyelim: Birincisi Östrojen, ikincisi ise testesteron’dur. Yani biri kadınlık, diğeri de erkeklik hormonudur. Birkaç atomluk bir fark bile, hayret verici biçimde, cinsiyet farklılıklarına sebep olmaktadır. C6H12O2 Yukarıdaki molekül, östrojen ve testesteron hormonları moleküllerine ne kadar da benziyor, değil mi ? Peki, bu molekül nedir ? Başka bir hormon mu? Hemen cevaplayalım: Bu molekül şeker molekülüdür. Aynı çeşit elementlerden oluşan bu üç molekül örneğinde, atom sayılarındaki farklılığın, ne derece farklı maddeler oluşturabildiği çok net olarak görülür. Bir tarafta cinsiyet oluşturan hormonlar, bir diğer tarafta da temel besin maddesi şeker var. |
İngiliz kimyager Nevil Sidgwick’de, Chemical Elements and Their Compounds (Kimyasal Elementler ve Bunların Bileşikleri) adlı eserinde karbonun canlılar için ne denli önemli olduğunu şöyle vurgular:
Karbon, yapabildiği bileşiklerin sayısı ve çeşitliliği yönünden, diğer elementlerden tamamen farklı, özgün bir yapıdadır. Şimdiye dek karbonun yarım milyonun üzerinde farklı bileşiği ayrılmış ve tanımlanmıştır. Ama bu bile karbonun güçleri hakkında çok yetersiz bir bilgi verir, çünkü karbon tüm canlı maddelerin temelini oluşturur.31
 |
| Çok değerli bir taş parçası olan elmas, doğada genelde grafit halinde bulunan karbonun bir türevidir. |
Karbonun sadece hidrojen ile kurduğu farklı bağlar, "hidrokarbonlar" olarak bilinen büyük bir aileyi meydana getirir. Bu aile içinde; doğal gaz, sıvı petrol, gaz yağı, kerosen ve çeşitli makina yağları vardır. Etilen ve propilen olarak bilinen hidrokarbonlar ise petrokimya endüstrisinin temelidir. Başka hidrokarbonlar da benzen, toluen ve turpentin gibi bileşikler meydana getirir. Giysilerimizi güvelenmekten koruması için dolaplara konan naftalin ise bir başka tür hidrokarbondur. Klor veya florla birleşen hidrokarbonlar ise anestezi maddeleri, yangın söndürücüler ve buzdolaplarında kullanılan freonlar gibi farklı maddeleri oluşturur.
Yukarıdaki sözünde kimyager Sidwick’in de belirttiği gibi içinde sadece 6 proton, 6 nötron ve 6 elektron bulunduran bu atomun gücünü tam anlayabilme konusunda insan aklı yetersiz kalmaktadır. Dolayısıyla bu atomun canlılık için önemli olan herhangi bir özelliğinin dahi tesadüfen oluşması imkansızdır. Kısacası herşeyi atomlarına kadar kuşatan Allah, karbon atomunu da canlıların bedenlerine uygun bir biçimde yaratmıştır.
Göklerde ve yerde ne varsa tümü Allah'ındır. Allah, her şeyi kuşatandır. (Nisa Suresi, 126)
Yan Yana Gelen Her Atom Hemen Reaksiyona Girseydi Ne Olurdu? | |
|
Az önce tüm evrenin 109 farklı elementin atomlarının birbirleriyle reaksiyona girmeleri sonucu oluştuğunu söylemiştik. Burada, üzerinde dikkatle durulması gereken bir nokta vardır; o da, tepkimenin oluşabilmesi için çok önemli bir koşulun gerçekleşmesi gerektiğidir. |
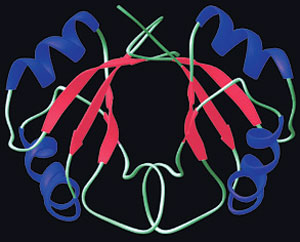 |
| Amino asitlerin dizilimi ve üç boyutlu şekli vücuttaki proteinlerin görevini/fonksiyonunu belirler. |
Atomları birbirine bağlayan bağlar bu bağlara nisbeten çok daha kuvvetlidirler. Bu bağlar sayesinde milyonlarca hatta milyarlarca çeşit molekül oluşabilir.
Peki maddeyi oluşturmak üzere moleküller nasıl birleşirler?
Moleküller oluştuktan sonra bir dengeye sahip oldukları için artık moleküller arasında elektron alışverişi olmaz.
Peki onları bir arada tutan şey nedir?
Bu soruyu cevaplamaya çalışan kimyacılar farklı teoriler üretmeye başlamışlardır. Yapılan araştırmalar moleküllerin içlerindeki atomların özelliklerine göre farklı şekillerde birleşebildiklerini ortaya çıkarmıştır.
Bu bağlar canlıların kimyası olarak bilinen organik kimya için çok önemlidir. Çünkü canlılığı meydana getiren en önemli moleküller bu bağı kurma özellikleri sayesinde ortaya çıkabilir. Protein örneğini ele alalım. Canlılığın temel yapı taşı olan proteinlerin, üç boyutlu kompleks şekilleri bu bağlar sayesinde meydana gelir. Yani canlılığın oluşması için atomlar arasındaki güçlü kimyasal bağ kadar moleküller arası zayıf kimyasal bağ da var olmalıdır. Elbette ki bu bağın kuvveti de belli bir ölçüye sahip olmalıdır.
Protein örneğinden devam edebiliriz. Proteinler aminoasit adlı moleküllerin birleşmesinden oluşan çok daha büyük moleküllerdir. Aminoasitleri meydana getiren atomlar kovalent bağ ile birleşirler. Zayıf bağlar da oluşan bu aminoasitleri üç boyutlu dizilimi elde edecek şekilde birbirine bağlar. Proteinler ancak bu üç boyutlu şekilleriyle var oldukları takdirde canlı organizmalarda fonksiyon gösterebilirler. Bu yüzden eğer bu bağlar olmasaydı proteinler ve dolayısıyla canlılık var olamazdı.
Bir çeşit zayıf bağ olan "hidrojen" bağları da hayatımızda çok önem taşıyan maddelerin baş aktörleridir. Örneğin yaşamın temeli olan "su"yu oluşturan moleküller hidrojen bağlarıyla bağlıdırlar.
 |
| Görmedin mi, Allah, gökten su indirdi, böylece yeryüzü yemyeşil donatıldı. Şüphesiz Allah, lütfedicidir, her şeyden haberdardır. (Hac Suresi, 63) |
Dünyamızın üçte ikisi yaşam için özel olarak seçilmiş bir sıvıyla, "su"yla kaplıdır. Yeryüzünde yaşayan bütün canlıların bedenleri %50-%95 oranında bu çok özel sıvıdan meydana gelir. Kaynama noktasına yakın sıcaklıktaki kaynaklarda yaşayan bakterilerden tutun da, erimekte olan buzulların üzerindeki bazı özel yosunlara kadar, suyun olduğu her yerde ve her sıcaklıkta hayat vardır. Yağmurdan sonra yapraklar üzerinde kalan bir su damlacığında bile binlerce mikroskobik canlı doğar, çoğalır ve ölür.
Hiç su olmasa yeryüzü nasıl görünürdü? Şüphesiz her yer çölden ibaret olurdu, denizlerin yerlerinde dipsiz ve ürkütücü çukurlar yer alırdı. Gökyüzü de bulutsuz ve çok garip bir renkte görülürdü.
Yeryüzündeki hayatın temeli olan suyun oluşabilmesi ise aslında son derece zordur. Öncelikle suyun bileşenleri olan hidrojen ve oksijen moleküllerini bir cam kabın içinde düşünelim. Bunları o kabın içinde çok uzun bir süre bırakalım. Bu gazlar kabın içinde yüzlerce yıl kalsalar, yine de su oluşturamayabilirler. Oluştursalar da çok yavaş olarak, mesela binlerce yıl gibi bir süre sonra kabın dibinde çok az miktarda su meydana gelebilir.
Böyle bir durumda suyun bu derece yavaş oluşmasının sebebi sıcaklıktır. Oda sıcaklığında oksijenle hidrojen çok yavaş tepkimeye girerler.
Oksijen ve hidrojen, serbest halde iken H2 ve O2 molekülleri halinde bulunur. Bu moleküllerin su molekülünü oluşturmak üzere birleşmeleri için çarpışmaları gerekir. Bu çarpışma sonucunda, hidrojen ile oksijen molekülünü oluşturan bağlar zayıflar ve oksijen ile hidrojen atomlarının birleşmesine engel kalmaz. Sıcaklık, bu moleküllerin enerjisini, dolayısıyla hızlarını yükselttiği için çarpışmaların sayısını da büyük ölçüde artırır. Böylece, tepkimenin hızlı ilerlemesini sağlar. Ancak, şu anda yeryüzünde suyun oluşmasını sağlayacak kadar yüksek ısı yoktur. Suyun oluşması için gerekli olan ısı, dünya oluşurken sağlanmış ve dünyanın dörtte üçlük kısmını oluşturan su o zaman meydana gelmiştir. Artık bu su kaynakları buharlaşarak atmosfere yükselmekte, orada da soğuyarak yağmur şeklinde yeniden yeryüzüne dönmektedir. Yani mevcut miktara yeni bir ilave olmaz, sadece bir devir daim yaşanır.
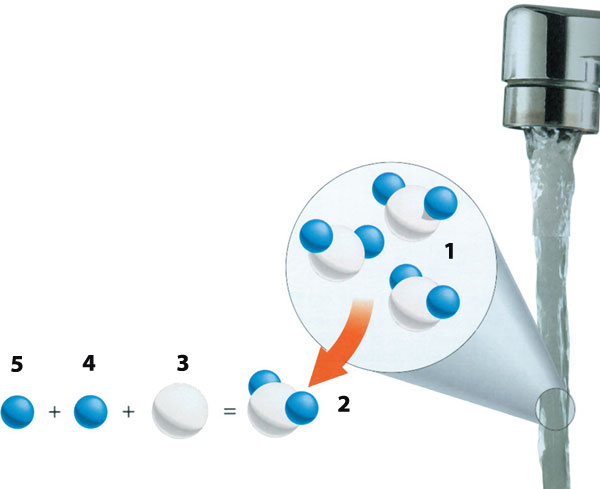 | |
| 1) Su molekülü | 4) hidrojen |
 |
| Eğer suyun üstten donma özelliği olmasaydı, denizlerin çok büyük bir bölümü tüm yıl boyunca donacak ve denizdeki canlı yaşamı çok büyük bir tehlikeye girecekti. |
Su, kimyasal olarak pek çok olağanüstü özelliğe sahiptir. Her bir su molekülü hidrojen ve oksijen atomlarının birleşmesiyle oluşmuştur. Biri yakıcı, diğeri de yanıcı olan iki gazın birleşerek bir sıvıyı, hem de suyu oluşturuyor olmaları oldukça ilginçtir.
Şimdi kısaca kimyasal olarak suyun nasıl oluştuğuna bakalım. Suyun elektrik yükü sıfır, yani nötrdür. Ancak oksijen ve hidrojen atomlarının büyüklüklerinden dolayı su molekülünün oksijen tarafı hafifçe eksi, hidrojen tarafı ise hafifçe artı yüklüdür. Birden fazla su molekülü bir araya geldiğinde artı ve eksi yükler birbirini çekerek "hidrojen bağı" denilen çok özel bir bağ oluşturur. Hidrojen bağı çok zayıf bir bağdır ve ömrü aklımızın kavrayamayacağı kadar kısadır. Bir hidrojen bağının ömrü, yaklaşık olarak bir saniyenin yüz milyarda biri kadardır. Ama bağlardan biri kırıldığında hemen bir diğer bağ oluşur. Böylece su molekülleri birbirlerine yapışırlar ve diğer taraftan zayıf bir bağla birbirlerine bağlandıklarından akışkan olurlar.
Hidrojen bağlarının suya kattığı bir başka özellik de, suyun sıcaklık değişimlerine direnç göstermesidir. Havanın sıcaklığı aniden artsa bile suyun sıcaklığı yavaş yavaş artar, aynı şekilde havanın sıcaklığı aniden düşse bile suyun sıcaklığı yavaş yavaş düşer. Suyun sıcaklığının önemli oranda oynayabilmesi için çok büyük miktarlarda ısı değişikliğine ihtiyaç vardır. Suyun ısı enerjisinin bu derece yüksek olmasının canlı hayatına sağladığı çok büyük faydalar vardır. Basit bir örnek verecek olursak, vücudumuzda çok büyük oranda su vardır. Su eğer havadaki ani sıcaklık iniş ve çıkışlarına aynı hızla uysaydı, aniden ateşimiz çıkardı veya aniden donardık.
 |
| Donan suyun yoğunluğu sıvı haldeki sudan daha az olduğu için buzlar suyun üstünde yüzerler. |
Aynı şekilde, suyun buharlaşmak için de çok büyük bir ısı enerjisine ihtiyacı vardır. Su buharlaşırken, çok ısı enerjisi kullandığı için suyun sıcaklığında eksilme olur. Yine insan vücudundan bir örnek verecek olursak; vücudumuzun normal sıcaklığı 360 C’dir ve dayanabileceğimiz en yüksek vücut sıcaklığı 420 C’dir. Aradaki bu 60 C’lik aralık çok küçük bir aralıktır ve birkaç saat güneş altında çalışmak vücut sıcaklığını bu kadar artırabilir. Ancak vücudumuz terleyerek, yani içindeki suyu buharlaştırarak çok büyük miktarda ısı enerjisi harcar ve vücut sıcaklığı düşer. Vücudumuz otomatik olarak çalışan böyle bir mekanizmaya sahip olmasaydı, birkaç saat güneş altında çalışmak bile bizler için öldürücü olabilirdi.
Hidrojen bağlarının suya kazandırdığı bir başka olağanüstü özellik, suyun sıvı iken katı haline oranla daha yoğun olmasıdır. Halbuki, yeryüzündeki maddelerin çoğu katı iken sıvı haline oranla daha yoğundur. Ancak, su diğer maddelerin tersine donarken genleşir. Bunun sebebi hidrojen bağlarının su moleküllerinin birbirlerine sıkı şekilde bağlanmasını engellemesi ve arada birçok boşluğun kalmasıdır. Su sıvı iken hidrojen bağları kırıldığından oksijen atomları birbirine yaklaşır ve daha yoğun bir yapı elde edilir.
Bu durum aynı şekilde buzun sudan daha hafif olmasını da beraberinde getirir. Normalde herhangi bir metali eritip içine aynı metalden birkaç katı parça atsanız, bu parçalar hemen dibe çöker. Ancak suda durum farklıdır. Onbinlerce ton ağırlığındaki buz dağları suyun üzerinde mantar gibi yüzmektedirler. Peki suyun bu özelliğinin ne gibi bir faydası olabilir?
Bu soruyu bir ırmak örneği ile cevaplayalım: Havalar çok soğuduğunda ırmaktaki suyun tamamı değil, sadece üst kısmı donar. Su, +40 C’de en ağır halindedir ve bu dereceye ulaşan su hemen dibe çöker. Suyun üzerinde ise "katman halinde buz" oluşur. Bu katmanın altında su akmaya devam eder ve +40 C canlıların yaşayabileceği bir sıcaklık olduğu için sudaki canlılar bu sayede hayatlarını sürdürür.
Allah’ın suya vermiş olduğu tüm bu eşsiz özellikler, yeryüzünde canlı hayatının var olabilmesini mümkün kılan özelliklerdir. Kuran’da Allah’ın insanlara sunduğu bu büyük nimetin önemi şöyle bildirilmiştir:
Sizin için gökten su indiren O’dur; içecek ondan, ağaç ondandır (ki) hayvanlarınızı onda otlatmaktasınız. Onunla sizin için ekin, zeytin, hurmalıklar, üzümler ve meyvelerin her türlüsünden bitirir. Şüphesiz bunda, düşünebilen bir topluluk için ayetler vardır. (Nahl Suresi, 10-11)
Hepimizin de bildiği gibi su 1000 C sıcaklıkta kaynar ve 00 C sıcaklıkta donar. Ancak, normal şartlarda suyun 1000 C değil, +1800 C kaynaması gerekirdi. Neden mi?
Periyodik tabloda aynı gruptaki elementlerin özellikleri, hafif elementten ağır elemente doğru düzenli olarak değişiklik gösterir. Bu düzenlilik, özellikle hidrojen bileşiklerinde hakimdir. Periyodik tabloda oksijenin bulunduğu grupta bulunan elementlerin bileşikleri "hidrid" diye adlandırılır. Su, aslında "oksijen hidrid"dir. Bu gruptaki diğer elementlerin hidridleri su molekülü ile aynı molekül yapısına sahiptir.
Bu bileşiklerin kaynama noktaları kükürtten başlayıp daha ağır olanlara doğru düzenli bir şekilde değişir; ancak umulmadık bir şekilde suyun kaynama noktası bu dizinin dışına çıkar. Su (oksijen hidrid) olması gerekenden 800 C daha aşağıda kaynar. Bir diğer şaşırtıcı durum da suyun donma noktası ile ilgilidir: Yine periyodik sistemdeki düzene göre, suyun -1000 C sıcaklıkta katılaşması gerekir. Ancak su bu kuralı bozar ve olması gerekenden 1000 C yukarıda, yani 00 C de buz haline gelir. Bu noktada; niçin hidridlerden başka biri değil de, sadece suyun (oksijen hidrid) periyodik sistem kurallarına uymadığı sorusu akla gelmektedir.
 |
| Bir sıvının yüzeyindeki moleküller içe doğru gerilen bir ağ gibidir. Bu da sıvılardaki yüzey gerilimini oluşturur. Bu gerilim yüzey moleküllerinin birbirlerine yakınlaşmasını sağlar, bu da bir sivrisineğin bacaklarının bu gerilimi kırıp, içeri girmesini engeller. Suyun yüksek yüzey gerilimi birçok fizyolojik işlem için hayati önem taşır. 32 |
Gerek fizik kuralları, gerek kimya kuralları ya da kural olarak nitelendirdiğimiz ne varsa; insanların, evrendeki olağanüstü dengenin ve yaratılışın detaylarını açıklama gayretinden başka şeyler değildirler. Özellikle de 20. Yüzyılda yapılan tüm araştırmalar, evrendeki tüm fiziksel dengelerin insan yaşamı için çok hassas bir biçimde ayarlandığını göstermektedir. Araştırmalar evrende var olan tüm fizik, kimya ve biyoloji kanunlarının, atmosferin, güneşin, atomların, moleküllerin insanın yaşamı için tam olmaları gereken şekilde düzenlendiklerini ortaya koymaktadır. Su da yukarıda saydığımız maddelerde olduğu gibi, başka hiçbir sıvıyla kıyaslanamayacak kadar yaşama uygundur ve dünyanın büyük bir bölümü, yaşam için tam gerekli miktarda su ile doldurulmuştur. Tüm bunların bir tesadüf olmayacağı ve ortada kusursuz bir düzenin, tasarımın olduğu apaçıktır.
Allah, gökleri ve yeri yaratan ve gökten su indirip onunla size rızık olarak türlü ürünler çıkarandır. Ve onun emriyle gemileri, denizde yüzmeleri için size, emre amade kılandır. Irmakları da sizin için emre amade kılandır. Güneşi ve ayı hareketlerinde sürekli emrinize amade kılan, geceyi ve gündüzü de emrinize amade kılandır. Size her istediğiniz şeyi verdi. Eğer Allah'ın nimetini saymaya kalkışırsanız, onu sayıp-bitirmeye güç yetiremezsiniz. Gerçek şu ki, insan pek zalimdir, pek nankördür. (İbrahim Suresi, 32-34)
Suyun insanı hayrete düşüren fiziksel ve kimyasal özellikleri, bu sıvının insan yaşamı için özel olarak yaratıldığını göstermektedir. Allah suyla insanlara hayat vermiş ve yaşamlarını devam ettirmeleri için gereksinim duydukları her şeyi de suyla topraktan bitirmiştir. Allah Kuran'da insanları bu konu üzerinde düşünmeye çağırır:
O, gökten su indirendir. Bununla her şeyin bitkisini bitirdik, ondan bir yeşillik çıkardık, ondan birbiri üstüne bindirilmiş taneler türetiyoruz. Ve hurma ağacının tomurcuğundan da yere sarkmış salkımlar, -birbirine benzeyen ve benzemeyen- üzümlerden, zeytinden ve nardan bahçeler (kılıyoruz.) Meyvesine, ürün verdiğinde ve olgunluğa eriştiğinde bir bakıverin. Şüphesiz inanacak bir topluluk için bunda gerçekten ayetler vardır. (Enam Suresi, 99)
Soluduğumuz hava, yani aşağı atmosfer büyük ölçüde oksijen gazından oluşur. Burada oksijenden kastettiğimiz O2 gazıdır. Yani aşağı atmosferdeki oksijen molekülleri 2’şer atomdan oluşmuştur. Ancak, oksijen molekülü bazen 3’er atomdan da (O3) oluşabilmektedir. Bu durumda bu molekül artık oksijen değil "Ozon" olarak isimlendirilir, zira bu iki gaz birbirlerinden çok farklıdırlar.
Hemen burada üzerinde durulması gereken bir nokta vardır: İki oksijen atomu birleşince oksijen gazı oluşmaktadır da, niçin üç oksijen atomu birleşince ozon gazı diye farklı bir gaz oluşmaktadır? Sonuçta iki de olsa, üç de olsa birleşen oksijen atomu değil midir? O zaman, neden ortaya iki farklı gaz çıkmaktadır? Bu soruyu cevaplamadan önce, bu iki gazın ne yönden farklı olduklarını ele alıp, bundan sonra cevap vermek daha yerinde olacaktır:
Oksijen gazı (O2) aşağı atmosferde bulunur ve solunum yoluyla yeryüzündeki tüm canlılara hayat verir. Ozon gazı (O3) ise, zehirli ve çok kötü kokulu bir gazdır. Atmosferin en üst tabakalarında bulunur. Eğer, oksijen yerine ozon solumak zorunda olsak hiçbirimiz yaşayamazdık.
 |
| 4) O3 5) Klor 6) O2 |
Ozon, yukarı atmosferdedir; çünkü orada canlı yaşamı için çok hayati bir fonksiyonu vardır. Atmosferin yaklaşık 20 km. yukarısında tüm dünyayı bir kuşak gibi saran bir tabaka oluşturur. Böylece güneşten gelen kızıl ötesi ışınları emerek, yeryüzüne tüm güçleriyle ulaşmalarını engeller. Kızıl ötesi ışınlar çok yüksek enerjiye sahip oldukları için, eğer yeryüzüne doğrudan ulaşırlarsa, yeryüzündeki her şey yanar ve dünyada hayat var olamaz. İşte bu yüzden ozon tabakası atmosferde koruyucu bir zırh görevi görmektedir.
Yeryüzündeki canlı hayatının var olabilmesi için tüm bu canlıların solunum yapabilmeleri ve zararlı güneş ışınlardan korunabilmeleri gerekmektedir. Ve bu sistemi oluşturan ancak ve ancak her atoma, her moleküle hakim olan Allah’tır. Allah’ın izni olmaksızın, hiçbir güç bu atomları oksijen ve ozon gazı molekülleri olarak farklı oranlarda bir araya getiremezdi.
 |
FURYLMETHANETHIOLBu molekül kahve aromasının kokusunu verir. Kahvenin uyarıcı etkisi kafeindir. Kahvenin rengi, nitrojen içeren organik maddelerin ısınmasıyla kahverengileşme reaksiyonunu sonucu ortaya çıkar. Çekirdekler arasında geçici olarak sıkışan moleküller tat ve uyarmanın nedenidir.36 |
Tat ve koku duyuları, insanın dünyasını güzelleştiren algılardır. Bu duyulardan alınan zevk çok eski çağlardan beri merak konusu olmuş ve bunların aslında moleküler etkileşimler oldukları çok yakın zamanlarda keşfedilmiştir.
"Tat" ve "koku" dediğimiz kavramlar, aslında birbirinden farklı moleküllerin duyu organlarımızda yarattığı algılarından başka bir şey değildir. Örneğin yiyeceklerin, içeceklerin, ya da çevremizde gördüğümüz çeşitli meyve ve çiçek kokularının hepsi uçucu moleküllerden ibarettir. Atomlar bir yandan canlı ve cansız maddeyi oluştururken, diğer taraftan da maddeye lezzet ve güzellik katmaktadırlar. Peki ama bu nasıl gerçekleşmektedir?
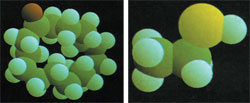 |
| Sağdaki resim kötü bir koku molekülüne, soldaki ise güzel bir koku molekülüne aittir. Görüldüğü gibi güzel koku ile çirkin kokuyu birbirinden ayıran gözle görülemeyen alemdeki bu ufacık farklardır. |
Vanilya kokusu, gül kokusu gibi uçucu moleküller, burnun epitelyum adı verilen bölgesindeki titrek tüylerinde bulunan alıcılara gelirler ve bu alıcılarla etkileşime girerler. Bu etkileşim beynimizde koku olarak algılanır. 2-3 cm2’lik bir koku alma zarıyla kaplı burun boşluğumuzda şu ana kadar yedi tip farklı alıcı tespit edilebilmiştir. Bu alıcılardan her birine temel bir koku denk düşer. Aynı şekilde insan dilinin ön tarafında da dört farklı tip kimyasal alıcı vardır. Bunlar da tuzlu, şekerli, ekşi ve acı tatlarına karşılık gelir. İşte tüm duyu organlarımızın alıcılarına gelen bu moleküller beynimiz tarafından kimyasal sinyaller olarak algılanır.
Günümüzde tat ve kokunun nasıl algılandığı, nasıl oluştuğu konusu anlaşılabilmiştir, ama bilim adamları neden bazı maddelerin çok, bazı maddelerin az koktuğu, neden bazılarının tatlarının hoş ve bazılarının da kötü olduğu konusunda bir görüş birliğine varamamışlardır.
Bir düşünelim. Hiçbir kokunun, hiçbir lezzetin var olmadığı bir dünyada da yaşıyor olabilirdik. Oysa ki kahverengi ve sadece kendine has bir kokusu olan topraktan yüzlerce çeşit, hoş kokulu ve lezzetli meyve, sebze ve binlerce renk, biçim ve kokuda çiçek çıkmaktadır. Lezzet ve koku kavramını bilmediğimiz için de, bu algılara sahip olmayı istemek aklımıza bile gelmezdi. O zaman bu atomlar bir yandan maddeyi oluşturmak için olağanüstü bir şekilde bir araya gelirlerken, neden ayrıca tat ve koku oluşturmak üzere de bir araya gelirler? Tat ve kokunun var olması insanlar için temel bir ihtiyaç değildir. Ama muhteşem bir sanatın ürünü olarak dünyamıza apayrı bir lezzet katmaktadırlar.
 |
PIPERINPiperin, tropik asma Piper nigrum’un yumuşak meyvesi olan siyah ve beyaz biberin aktif bir elementidir. Siyah biber ham meyvenin fermentasyona bırakılması ve sonra da kurutulması ile elde edilir. Beyaz biber ise olgunlaşmış meyvenin kabuğu ve etinin ayrılması ve tohumlarının kurutulması yoluyla elde edilir. 34 |
 |
Para-HYDROXYPHENOL -2-BUTANON ve IONONBu iki molekül bir karışımda bir araya gelerek çok hoş bir kokunun oluşmasına neden olurlar. Olgun böğürtlen kokusunun nedeni butanon'dur. Yeni koparılan taze meyve kokusunun kaynağı aynı zamanda kurumuş saman ve menekşe kokusunun kaynağı olan ionon’dan gelir. Ionon menekşe yağınının güzel kokusudur.35 |
Diğer canlılarla bir karşılaştırma yaparsak, kimi canlılar sadece ot, kimileri de daha farklı maddeler yer. Şüphesiz ki bunların ne hoş kokuları, ne de hoş lezzetleri vardır, zaten olsa bile şuura sahip olmayan bu canlılar için lezzetin bir önemi yoktur. Bizler de gayet tabii, onlar gibi tek çeşit gıda ile beslenebilirdik. Ömrünüzün sonuna kadar sadece tek bir çeşit yemek yeseydiniz ve yalnızca su içseydiniz hayatınız ne kadar sıradan ve lezzetsiz olurdu değil mi? Bu açıdan tat ve koku da diğer tüm nimetler gibi, sonsuz lütuf ve ikram sahibi Allah'ın insana karşılıksız sunduğu güzelliklerdendir. Yalnızca bu iki algının var olmaması dahi insanın hayatını büyük ölçüde tatsızlaştırmaya yeterdi. Kendisine verilen tüm bu nimetlere karşılık, insana düşen kuşkusuz kendisini her yönden kuşatmış böyle sonsuz bir ikram karşısında Allah’ın dilediği gibi bir kul olmaya çalışmaktır. Böyle bir tutum karşısında Rabbimiz kendisine, bu dünyada yalnızca birer örneğini sunduğu nimetlerin çok daha üstünlerini sınırsız bir biçimde barındıran ebedi bir hayatı vaat etmektedir. Aksine nankörlük, umursuzluk yapılarak gaflet içinde geçirilen bir yaşamın karşılığı ise şüphesiz yine adaletli bir karşılık olacaktır:
Rabbiniz şöyle buyurmuştu: Andolsun, eğer şükrederseniz gerçekten size arttırırım ve andolsun, eğer nankörlük ederseniz, şüphesiz, Benim azabım pek şiddetlidir. (İbrahim Suresi, 7)
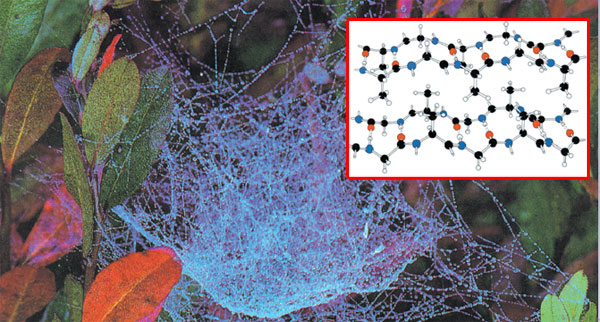 |
KERATINKeratin ipek böcekleri ve örümcekler tarafından salgılanan, katılaşmış çok değerli bir sıvıdır. İpek polipeptit zincirle birbirine bağlı amino asitlerden oluşmaktadır. Zincirler ise hidrojen bağları ile biribirilerine bağlıdırlar ve oldukça büzüşük ancak neredeyse düz levhalar halindedirler. Örümcek ağlarında da aynı ipek dokusuyla karşılaşırız. 37 |
Buraya kadar okuduklarımız, madde adını verdiğimiz şeyin hiç de zannettiğimiz gibi belirli bir renge, kokuya, şekle sahip bir bütün olmadığını ortaya koydu. Madde sandığımız şey, yani kendi bedenimiz, odamız, evimiz, hatta dünya ve tüm evren gerçekte bir enerji yumağından başka birşey değildir. O zaman, çevremizdeki bunca şeyi gözle görünür ve elle tutulur kılan nedir?
Çevremizdekileri madde olarak algılamamızın sebebi, atomların yörüngelerindeki elektronların fotonlarla çarpışmaları, atomların birbirlerini itmeleri veya çekmeleridir.
Şu anda elinizde tuttuğunuzu sandığınız kitaba aslında dokunmuyorsunuz bile... Gerçekte, elinizin atomları kitabın atomlarını itmekte ve bu itmenin şiddetine göre de dokunma hissiniz gerçekleşmektedir. Çünkü atomların yapısından bahsedilirken de belirtildiği gibi atomlar birbirlerine en fazla bir atomun çapı kadar yaklaşabilirler. Üstelik birbirlerine bu kadar yaklaşabilen atomlar da ancak birbirleriyle reaksiyona giren atomlardır. Şu halde, aynı maddenin atomları bile birbirlerine kesinlikle dokunamazlarken bizler elimizle tuttuğumuz, sıktığımız veya tutup havaya kaldırdığımız maddeye asla dokunamayız. Kaldı ki, elimizdeki maddeye maksimum yaklaşmamız mümkün olsaydı bile, o zaman da bu maddeyle kimyasal reaksiyona girerdik. Böyle bir durumda ise insan veya başka bir canlının bir saniye bile varlığını sürdürmesi söz konusu olamazdı. Canlı ayak bastığı, oturduğu veya dayandığı madde ile hemen kimyasal reaksiyona girer ve garip bir varlık haline dönüşürdü.
Bu durumda ortaya çıkan manzara son derece düşündürücüdür: Gerçekte, % 99.95’i boş olan ve neredeyse sadece enerjiden ibaret atomlardan oluşan bir dünyada yaşıyoruz.38 "Dokunuyoruz ve tutuyoruz" dediğimiz şeylere de aslında hiçbir zaman dokunamıyoruz. Peki ya gördüğümüz, duyduğumuz veya kokladığımız maddeyi ne derece algılıyoruz? Bu maddeler, gerçekte gördüğümüz, duyduğumuz gibi midir? Kesinlikle hayır... Elektronlardan ve moleküllerden bahsederken bu konuyu ele almıştık. Burada tekrar hatırlayacak olursak; var dediğimiz ve gördüğümüz maddeyi aslında doğrudan görmemiz asla mümkün değildir. Çünkü görüyoruz dediğimiz olay aslında Güneş'ten veya başka bir ışık kaynağından gelen ışık taneciklerinin (fotonlarının) maddeye çarpması, bu maddenin gelen ışığın bir kısmını soğurması ve kalanını dışarı vermesi sonucunda maddeden yansıyarak gözümüze çarpan fotonların, beynimizde oluşturduğu birtakım görüntülerdir. Yani gördüğümüz madde ancak bizim gözümüze yansıyan fotonların taşıdığı bilgiden ibarettir. Peki bu bilgiler maddeyle ilgili bilginin ne kadarını bize yansıtır? Dışarıda var olan maddelerin gerçek halinin bize tam olarak yansıtıldığına dair elimizde hiçbir kanıtımız yoktur.
25. Martin Sherwood & Christine Sulton, The Physical World, Oxford University Press, 1988, s. 81
26. Martin Sherwood & Christine Sulton, The Physical World, Oxford University Press, 1988, s. 82
27. Martin Sherwood & Christine Sulton, The Physical World, Oxford University Press, 1988, s. 79
28. Vlasov Trifonov, 107 Kimya Öyküsü, TÜBİTAK Yayınları, s. 117
29. Vlasov Trifonov, 107 Kimya Öyküsü, TÜBİTAK Yayınları, s. 118
30. David Burnie, Life, Eyewitness Science, London: Dorling Kindersley, 1996, s.8
31. Nevil V.Sidgwick, The Chemical Elements and Their Compounds, vol.1, Oxford: Oxford University Press, 1950, s.490
32. Martin Sherwood & Christine Sulton, The Physical World, Oxford University Press, 1988, s. 30
33. Structure of Matter, The Time Inc. Book Company, s. 70, 1992
34. Molecules, Scientific American Library, P.W. Atkins, s. 115
35. Molecules, Scientific American Library, P.W. Atkins, s. 128
36. Molecules, Scientific American Library, P.W. Atkins, s. 130
37. Molecules, Scientific American Library, P.W. Atkins, s. 93
38. Taşkın Tuna, Uzayın Ötesi, Boğaziçi Yayınları, 1995, s. 166