Dietro l’universo c’è una mente e uno scopo. Segni di questa presenza divina sono presenti nel modo in cui la matematica astratta riesce a penetrare i segreti dell’universo, perché ciò indica che il mondo è stato creato da una mente razionale. La natura è stata “calibrata” con cura per consentire alla vita e alla coscienza di nascere. John Polkinghorne, fisico inglese 84
Finora abbiamo esaminato come tutti gli equilibri dell’universo in cui viviamo siano stati disegnati appositamente per consentirci di vivere. Abbiamo visto come la struttura generale dell’universo, l’ubicazione della Terra, i fattori quali aria, luce e acqua siano stati disegnati precisamente con le caratteristiche di cui noi abbiamo bisogno. Tuttavia, oltre a ciò, dobbiamo dare uno sguardo anche agli elementi che compongono il nostro corpo. Gli elementi chimici, i componenti che formano le mani, gli occhi, i capelli, gli organi e anche tutti gli esseri viventi (piante e animali) che sono fonte di cibo, sono stati disegnati appositamente per svolgere il ruolo che devono compiere.
Su questo disegno supremo e sui componenti della vita, il fisico Robert E. D. Clark afferma: "è come se il Creatore ci avesse fornito a portata di mano un kit di parti prefabbricate pronte per un lavoro”.85
Il più importante dei componenti è il carbonio.
Nei capitoli precedenti, abbiamo descritto lo straordinario processo tramite cui il carbonio, l’elemento che occupa la sesta posizione nella tavola periodica, viene prodotto nel cuore delle enormi stelle chiamate “giganti rosse”. Abbiamo visto anche come, avendo scoperto questo meraviglioso processo, Fred Hoyle sia stato spinto ad affermare che “le leggi della fisica nucleare sono state volutamente ideate in vista delle conseguenze che producono all’interno delle stelle."86

La grafite è una forma naturale di carbonio puro. Quando si combina con atomi di altri elementi, questo elemento è in grado di formare una straordinaria gamma di sostanze diverse. La struttura principale del corpo umano è il risultato dei diversi legami chimici con cui è in grado di interagire il carbonio.
Quando esaminiamo il carbonio più da vicino, possiamo vedere che non solo la formazione fisica di questo elemento, ma anche le sue proprietà chimiche sono state predisposte per essere così come sono.
In natura, il carbonio puro si presenta in due forme: grafite e diamanti. Tuttavia il carbonio si lega a molti altri elementi dando vita a tanti diversi tipi di sostanze. In particolare, la gamma di materiali organici (la membrana di una cellula, la corteccia dell’albero, il cristallino di un occhio, il corno di un cervo, il bianco dell’uovo e il veleno di un serpente) sono tutti composti a base di carbonio. Il carbonio, combinato con idrogeno, ossigeno e azoto in quantità e disposizioni geometriche diverse, dà origine a un vasto assortimento di materiali con proprietà molto differenti.
Alcune molecole dei composti di carbonio sono costituite da pochi atomi; altre ne contengono migliaia o persino milioni. Inoltre, nessun altro elemento è così versatile come il carbonio nel formare molecole con una tale stabilità e durabilità. Per citare David Burnie nel suo libro Life:
Il carbonio è un elemento molto insolito. Senza la sua presenza e le sue proprietà insolite, la presenza di forme di vita sulla Terra sarebbe improbabile.87
In Chemical Elements and their Compounds, il chimico inglese Nevil Sidgwick riguardo al carbonio scrive:
Tra tutti gli elementi, il carbonio è impareggiabile nel numero e nella varietà di composti che può formare. Più di un quarto di milione sono già stati isolati e descritti, ma ciò dà un’idea incompleta dei sui poteri poiché è alla base di tutte le forme di materia vivente.88
Sia per ragioni fisiche che chimiche è impossibile che la vita possa basarsi su un elemento che non sia il carbonio. Un tempo si pensava che il silicio fosse un altro elemento su cui potesse basarsi la vita. Tuttavia adesso sappiamo che tale ipotesi è impossibile. Per citare nuovamente Sidgwick:
Adesso ne sappiamo abbastanza da essere certi che è impensabile l’idea di un mondo in cui il silicio possa prendere il posto del carbonio come base per la vita…89
I legami chimici cui prende parte il carbonio per formare i composti organici sono chiamati “legami covalenti”. Si ha un legame covalente quando due atomi condividono i loro elettroni.
Gli elettroni di un atomo occupano orbitali specifici che sono disposti intorno al nucleo. L’orbitale più vicino al nucleo può essere occupato da non più di due elettroni. Nell’orbitale successivo c’è posto per un massimo di otto elettroni. Nel terzo orbitale ce ne possono entrare fino a diciotto. Più aumenta il numero di orbitali e maggiore è il numero di elettroni. Un aspetto interessante di questo schema è che gli atomi sembrano “voler” completare il numero di elettroni nei loro orbitali. L’ossigeno, ad esempio, ha sei elettroni nel suo seconda (e più esterno) orbitale e ciò ne “agevola” la combinazione con altri atomi che forniranno i due ulteriori elettroni necessari per portarne il numero a otto (non è stata mai data una spiegazione del motivo per cui gli atomi si comportano così, ma è un bene che accada: se così non fosse la vita non sarebbe possibile).
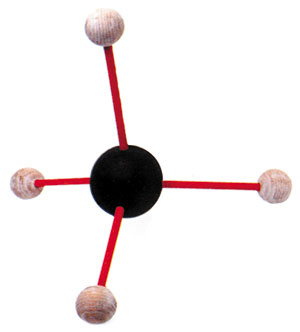
La struttura del metano: quattro atomi di idrogeno condividono un elettrone ciascuno con un solo atomo di carbonio
I legami covalenti sono il risultato di questa tendenza degli atomi a completare i loro orbitali. La condivisione degli elettroni porta spesso ad amman chi negli orbitali degli atomi. Un esempio è dato dalla molecola (H2O), i cui componenti (due atomi di idrogeno e un atomo di ossigeno) formano un legame covalente. In questo composto, l’ossigeno completa il numero di elettroni nel suo secondo orbitale (portandoli a otto) condividendo i due elettroni (uno ciascuno) negli orbitali dei due atomi di idrogeno; allo stesso modo ogni atomo di idrogeno “prende in prestito” un elettrone dall’ossigeno per completare i propri orbitali.
Il carbonio riesce bene a formare legami covalenti con altri atomi (inclusi gli atomi di carbonio) da cui può derivare un numero enorme di composti diversi. Uno dei composti più semplici è il metano: un gas comune formato dal legame covalente di quattro atomi di idrogeno e di un atomo di carbonio. Con solo sei elettroni, gli orbitali più esterni del carbonio non raggiungono gli otto di cui hanno bisogno (mancano quattro elettroni anziché due come nel caso dell’ossigeno) e, per questa ragione, necessitano di quattro atomi di idrogeno per completarli.
Abbiamo detto che il carbonio è un elemento versatile nel formare legami con altri atomi e che questa versatilità rende possibile una gran quantità di composti diversi. La classe di composti formati esclusivamente dal carbonio e dall’idrogeno vengono chiamati “idrocarburi”. Si tratta di un’enorme famiglia di composti che comprende gas naturale, petrolio liquido, kerosene e olii lubrificanti. Idrocarburi quali etilene e propilene sono il fondamento su cui è stata eretta la moderna industria petrolchimica. Idrocarburi quali benzene, toluene, e trementina sono ben noti a chi lavora con la pittura. Anche la naftalina, che protegge i nostri indumenti dalle tarme, è un idrocarburo. Con l’aggiunta di cloro, alcuni idrocarburi diventano anestetici; con il fluoro, otteniamo il freon, un gas largamente usato nella refrigerazione.
C’è un’altra classe importante di composti in cui il carbonio, l’idrogeno e l’ossigeno formano legami covalenti fra di loro. Di questa famiglia fanno parte gli alcool quali etanolo e propanolo, chetone, aldeide, acidi grassi e molte altre sostanze. Un altro gruppo di sostanze composte da carbonio, idrogeno e ossigeno sono gli zuccheri, inclusi il glucosio e il fruttosio.

L’olio di oliva, la carne e lo zucchero non raffinato: tutto ciò che mangiamo è costituito da disposizioni diverse di idrogeno, ossigeno e carbonio con l’aggiunta di altri atomi, ad esempio quello dell’azoto.
La cellulosa che compone la struttura del legno e il materiale grezzo per la carta è un carboidrato. Così come lo sono anche l’aceto, la cera d’api e l’acido formico. Qualsiasi sostanza o materiale particolarmente elaborato esistente in natura non è altro che una combinazione diversa di carbonio, idrogeno e ossigeno, tenuta insieme da legami covalenti.
Quando il carbonio, l’idrogeno, l’ossigeno e l’azoto formano tali legami, il risultato è una classe di molecole che è il fondamento e la struttura della stessa vita: gli amminoacidi che formano le proteine. Anche i nucleotidi che costituiscono il DNA sono molecole formate da carbonio, idrogeno, ossigeno e azoto.
In pratica, i legami covalenti di cui fa parte l’atomo di carbonio sono vitali per l’esistenza della vita. Se l’idrogeno, il carbonio, l’azoto e l’ossigeno non fossero così “disposti” a condividersi gli elettroni, la vita non sarebbe possibile.
La caratteristica che consente al carbonio di formare questi legami è una proprietà che i chimici chiamano “metastabilità”, ossia la particolarità di avere solo un leggero margine di stabilità. Il biochimico J. B. S. Haldane la descrive così:
Si definisce metastabile quella molecola che sprigiona energia libera da una trasformazione, ma è abbastanza stabile per durare a lungo, salvo che non sia attivata da calore, radiazioni, o unioni con un catalizzatore.90
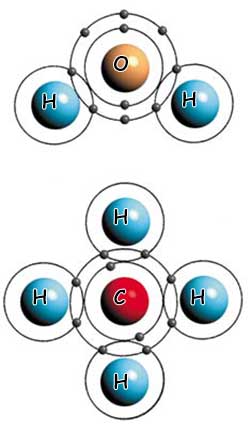
ACQUA E METANO: DUE DIVERSI ESEMPI DI LEGAMI COVALENTI
Nella molecola di acqua (sopra), esiste un legame covalente tra due atomi di idrogeno e un atomo di ossigeno. Nella molecola di metano (sotto) quattro atomi di idrogeno formano legami covalenti con un solo atomo di carbonio.
Quello che dice questa definizione semitecnica è che il carbonio possiede una struttura piuttosto singolare che, in normali condizioni, gli consente di formare legami covalenti.
Ma è proprio qui che la situazione comincia a diventare curiosa perché il carbonio è metastabile solo entro una gamma di temperature molto ristretta. In modo specifico, i composti diventano instabili quando la temperatura supera i 100°C.
Questo fatto è così comune nella nostra vita che quasi non ci facciamo caso. Quando cucianimo la carne, ad esempio, ciò che stiamo compiendo è il mutamento della struttura dei suoi composti di carbonio. Ma, in particolare, dobbiamo sottolineare che: la carne cotta è diventata completamente “morta”, ossia la sua struttura chimica è diversa da quando faceva parte dell’organismo vivente. La realtà è che la maggior parte dei composti di carbonio si denatura quando la temperatura supera 100°C: a una tale temperatura, ad esempio gran parte delle vitamine si dissolvono; anche gli zuccheri subiscono dei cambiamenti strutturali e perdono parte del loro valore nutritivo; a circa 150°C, i composti di carbonio cominciano a bruciare.
In altre parole, affinché gli atomi di carbonio compongano legami covalenti con altri atomi e i composti risultanti rimangano stabili, la temperatura ambientale non deve superare i 100°C. L’altro limite, quello più basso, è di circa 0°C: se la temperatura scende troppo al di sotto non può esistere alcuna biochimica organica.
Nel caso degli altri composti la situazione cambia. La maggioranza dei composti inorganici non è metastabile, ossia la loro stabilità non risente tanto dei cambiamenti di temperatura. Facciamo un esperimento. Poggiamo un pezzo di carne sull’estremita di un pezzo di metallo (ferro, ad esempio) lungo e sottile e riscaldiamo entrambe le estremità su una fonte di calore. Man mano che la temperatura aumenta, la carne si scurisce e finirà per bruciarsi molto prima che qualcosa avvenga al metallo. La stessa cosa accadrebbe se si sostituisse il metallo con la pietra o il vetro. Si dovrebbe aumentare la temperatura fino a molte migliaia di gradi prima che possa cambiare la struttura di questi materiali.
Vi sarete dunque accorti della somiglianza tra la gamma di temperatura necessaria alla formazione di legami covalenti dei composti di carbonio e alla loro stabilità e la gamma di temperatura che prevale sul nostro pianeta. Come affermato in precedenza, nell’intero universo le temperature variano da milioni di gradi nel cuore delle stelle allo zero assoluto (-273,15°C). Ma la Terra, concepita per consentire la vita all’umanità, possiede la ristretta gamma di temperatura essenziale alla formazione dei composti di carbonio che sono i componenti della vita.
Ma le “coincidenze” curiose non finiscono qui. Lo stesso intervallo di temperatura è l’unico in cui l’acqua rimane in forma liquida. Come abbiamo visto nel capitolo precedente, l’acqua allo stato liquido è uno dei fondamenti della vita e, per rimanere in questo stato, necessita esattamente delle stesse temperature necessarie ai composti di carbonio per formarsi e rimanere stabili. Non esiste alcuna “legge” fisica o naturale a dettarlo, e date le circostanze, è evidente in questa situazione che le proprietà fisiche dell’acqua, il carbonio e le condizioni del pianeta Terra sono stati creati per essere in armonia fra loro.
I legami covalenti non sono gli unici tipi di legami chimici che mantengono stabili i composti della vita. Esiste un’altra e diversa categoria chiamata “legami deboli”.
Questi legami sono circa venti volte più deboli di quelli covalenti, da qui il loro nome; ma non sono meno importanti per i processi di chimica organica. È grazie a questo legame debole che le proteine che costituiscono i componenti degli esseri viventi riescono a mantenere le loro complesse e fondamentali strutture tridimensionali.
Per spiegare ciò dobbiamo parlare brevemente della struttura delle proteine. Le proteine vengono anche definite “catene” di amminoacidi. Questa metafora è corretta ma allo stesso tempo incompleta. È incompleta perché per la maggior parte delle persone una “catena di amminoacidi” fa venire in mente l’immagine di qualcosa simile a un filo di perle mentre invece gli amminoacidi che compongono le proteine hanno una struttura tridimensionale a forma di albero con rami frondosi.
Sono i legami covalenti a tenere uniti gli atomi degli amminoacidi. I legami deboli, invece, ne mantengono la struttura tridimensionale. E, naturalmente, senza proteine non ci sarebbe vita.
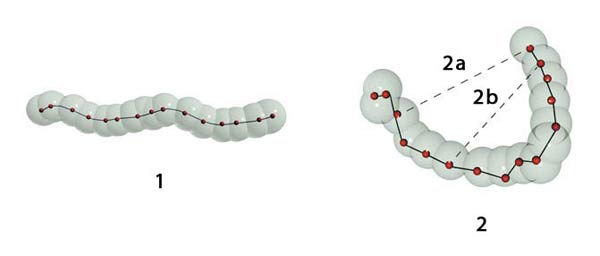
1. Legami covalenti: gli atomi sono saldamente legati l’uno all’altro
2. Legami deboli: un composto organico viene mantenuto in un’unica forma tridimensionale attraverso legami (le linee spezzate) deboli (non covalenti).
2a. Legame debole, 2b. Legame debole
L’aspetto interessante è che la gamma di temperatura in cui entrano in gioco i legami deboli è la stessa di quella che prevale sulla Terra. È piuttosto strano perché la natura fisica e chimica dei legami covalenti e quella dei legami deboli sono del tutto diverse e indipendenti l’una dall’altra. In altre parole, non esiste alcuna ragione intrinseca per cui entrambe debbano aver bisogno della stessa gamma di temperatura. Eppure, entrambi i tipi di legame possono manifestarsi e rimanere stabili solo all’interno di questa ristretta gamma di temperatura. E se così non fosse, cioè se i legami covalenti richiedessero una gamma di temperatura diversa da quella dei legami deboli, sarebbe impossibile costruire le strutture tridimensionali delle proteine.
Ogni aspetto delle straordinarie proprietà dell’atomo di carbonio analizzate finora ci dimostra che esiste un’armonia perfetta tra questo elemento (che è il componente fondamentale della vita), l’acqua (che è altrettanto vitale per la vita) e il pianeta Terra (che è il rifugio della vita). In Nature's Destiny, Michael
Denton sottolinea l’aspetto dell’idoneità:
Rispetto alla vasta gamma di temperature nel cosmo, c’è solo una minuscola banda di temperatura in cui abbiamo (1) acqua allo stato liquido, (2) una gran quantità di composti organici metastabili e (3) legami deboli per stabilizzare le forme tridimensionali delle molecole complesse.91
Tra tutti i corpi celesti osservati finora, questa “minuscola banda di temperatura” esiste solo sulla Terra. Inoltre, è solo su questo pianeta che abbandonano i due componenti fondamentali della vita: il carbonio e l’acqua.
Ciò indica che l’atomo di carbonio e le sue straordinarie proprietà sono statie concepiti appositamente per la vita e che il nostro pianeta è stato creato apposta per ospitare le forme di vita a base di carbonio.
Abbiamo visto come il carbonio sia il più importante componente degli organismi viventi e come sia stato concepito apposta per svolgere la sua funzione. Tuttavia, l’esistenza di tutte le forma di vita a base di carbonio dipende da un secondo imperativo: l’energia. L’energia è un requisito necessario per la vita.
Le piante ottengono l’energia dal Sole attraverso il processo di fotosintesi. Per il resto delle creature viventi della Terra (noi inclusi) l’unica fonte di energia è un processo chiamato ossidazione, parola sofisticata per intendere combustione. L’energia degli organismi che respirano ossigeno deriva dalla combustione dei nutrimenti che provengono dalle piante e dagli animali. Come si evince dalla parola ossidazione, questa combustione è una reazione chimica in cui le sostanze vengono ossidate (ossia combinate con l’ossigeno). Ecco spiegato perché l’ossigeno è importante per la vita al pari del carbonio e dell’idrogeno.
Una formula generalizzata di “combustione” (ossidazione) appare così:
composto di carbonio + ossigeno > acqua + anidride carbonica + energia
Ciò significa che quando si combinano composti di carbonio e ossigeno (nelle condizioni adatte), avviene una reazione che genera acqua e anidride carbonica e che rilascia una notevole quantità di energia. Questa reazione si riscontra per lo più negli idrocarburi (composti di idrogeno e carbonio). Nel nostro corpo ciò che viene bruciato per fornirci energia è il glucosio (uno zucchero e anche un idrocarburo).
Gli elementi di idrogeno e carbonio che costituiscono gli idrocarburi sono i più adatti per far avvenire l’ossidazione. Tra tutti gli altri atomi, quelli dell’idrogeno sono quelli che si combinano più facilmente con l’ossigeno e durante il processo viene rilasciata una gran quantità di energia. Se si ha bisogno di un combustibile che si combini con l’ossigeno, non c’è nulla di meglio dell’idrogeno. Dal punto di vista del suo valore come combustibile, il carbonio si classifica al terzo posto dopo l’idrogeno e il boro. In The Fitness of the Environment, Lawrence Henderson commenta così la staordinaria idoneità che ha luogo in questo caso:
Le trasformazioni chimiche, che per molte altre ragioni sembrano essere le più adatte a diventare processi di fisiologia, si dimostrano essere quelle che deviano il più grande flusso di energia nella corrente di vita.92
Come abbiamo visto, la reazione fondamentale che rilascia l’energia necessaria per la sopravvivenza degli organismi che respirano ossigeno è l’ossidazione degli idrocarburi. Ma questo semplice fatto solleva una questione problematica: se i nostri corpi sono fatti essenzialmente di idrocarburi, perché non vengono ossidati? In altre parole, perché non bruciamo come un cerino acceso?
I nostri corpi sono in contatto perenne con l’ossigeno dell’aria ma non si ossidano: non prendono fuoco. Perché?
La ragione di tale paradosso è che, in normali condizioni di temperatura e pressione, la forma molecolare dell’ossigeno (O2) ha un sostanziale grado di inerzia o “nobiltà” (i chimici usano il termine nobiltà per indicare la riluttanza o inabilità di una sostanza a innescare una reazione chimica con altre sostanze). Ma sorge un’altra questione: se l’ossigeno molecolare è così “nobile” da evitare di incenerirci, com’è fatta questa molecola che innesca le reazioni chimiche nel nostro corpo?
La risposta a questa domanda, che lasciava perplessi i chimici dei primi anni dell’Ottocento, non ha ottenuto risposta prima della seconda metà del Novecento quando i ricercatori biochimici hanno scoperto l’esistenza di enzimi nel corpo umano la cui funzione è quella di costringere l’O2 nell’atmosfera a innescare reazioni chimiche. Come risultato di una serie di processi estremamente complessi, questi enzimi utilizzano come catalizzatori atomi di ferro e rame nei nostri corpi. Per catalizzatore si intende quella sostanza che dà origine a una reazione chimica e che le consente di proseguire in condizioni diverse (ad esempio basse temperature ecc.) e che, altrimenti, non avverrebbe.93
In altre parole, la situazione è la seguente: l’ossigeno dà origine all’ossidazione e alla combustione e normalmente ci si aspetterebbe che portasse anche alla nostra combustione. Per prevenire ciò, alla forma molecolare O2 dell’ossigeno che esiste nell’atmosfera è stato dato un forte elemento di nobiltà chimica. Ossia, non innesca reazioni facilmente. Ma, dall’altro lato, i nostri corpi dipendono dalla proprietà ossidante dell’ossigeno per ricavare energia e, per questa ragione, le nostre cellule sono state provviste di un sistema di enzimi molto complesso che rende questo gas nobile estremamente reattivo.
Visto che ci siamo dobbiamo anche sottolineare che questo sistema di enzimi è un fantastico esempio di disegno che nessuna teoria evoluzionistica, che sostiene che la vita si sia sviluppata per caso, potrà mai sperare di spiegare.94
Ma esiste un’altra precauzione che previene la combustione del nostro corpo: quella che il chimico inglese Nevil Sidgwick chiama "caratteristica inerzia del carbonio”.95 Ciò significa che anche il carbonio, in normali condizioni di pressione e temperatura, non si affretta a innescare reazioni con l’ossigeno. Espresso nel linguaggio della chimica potrebbe sembrare alquanto arcano, ma in realtà quello che si sta dicendo è qualcosa che chiunque abbia avuto a che fare con l’accensione di un camino pieno di ciocchi o di una stufa a carbone in inverno o un barbecue in estate sa già: per accendere il fuoco bisogna stare attenti ai preliminari (materiale per accendere il fuoco, accendino ecc.) e anche innalzare la temperatura del combustile a un grado elevato. Ma una volta che il combustile comincia a bruciare, il carbonio che esso contiene innesca abbastanza rapidamente una reazione con l’ossigeno e viene sprigionata una gran quantità di energia. Ecco perché è così difficile accendere un fuoco senza un’altra fonte di calore. Ma dopo che ha inizio la combustione, viene prodotta una gran quantità di calore e ciò comporta la combustione di altri composti di carbonio vicini e così il fuoco divampa.
Se approfondiamo di più l’argomento, noteremo che anche il fuoco è un interessante esempio di disegno. Le proprietà chimiche dell’ossigeno e del carbonio sono state concepite in modo che questi due elementi si combinassero fra loro (combustione) solo in presenza di una gran quantità di calore. Ed è un bene che sia così perché, se non lo fosse, la vita su questo pianeta sarebbe sgradevole se non addirittura impossibile. Se il carbonio e l’ossigeno fossero anche solo leggermente più disposti a reagire tra loro, ogni volta che fa caldo avverrebbe la combustione spontanea (autocombustione) delle persone, degli alberi e degli animali. Nel deserto, ad esempio, si potrebbe andare a fuoco facilmente a mezzogiorno quando il caldo raggiunge il suo picco massimo; anche le piante e gli animali sarebbero esposti allo stesso rischio. Anche se la vita fosse possibile in un mondo simile, non sarebbe certo molto divertente.
Invece, se il carbonio e l’ossigeno fossero leggermente più “nobili” (ossia meno reattivi) sarebbe molto più difficile o addirittura impossibile accendere un fuoco. E senza fuoco non solo saremmo incapaci di riscaldarci, ma non ci sarebbe stato alcun processo tecnologico sul nostro pianeta perché quel processo dipende dalla capacità di lavorare i materiali quali il metallo e, senza il calore sprigionato dal fuoco, sarebbe impossibile lavorare e purificare il metallo.
Ciò dimostra che le proprietà chimiche del carbonio e dell’ossigeno sono state concepite perché fossero le più adatte alle esigenze del genere umano. A questo riguardo, Michael Denton afferma:
Questa curiosa non reattività degli atomi di carbonio e di ossigeno a temperatura ambiente, insieme alle enormi energie proprie della combinazione ottenuta, è di grande importanza adattativa per la vita sulla Terra. È questa combinazione curiosa che non solo offre alle forme di vita avanzate vaste energie di ossidazione in modo ordinato e controllato ma ha reso possibile anche l’uso del fuoco da parte del genere umano e ha consentito lo sfruttamento delle enormi energie di combustione per lo sviluppo della tecnologia.96
In altre parole, sia il carbonio che l’ossigeno sono stati creati con proprietà che si sono rivelate adatte alla vita umana. Le proprietà di questi due elementi ci consentono di accendere il fuoco e di utilizzarlo nel modo a noi più congeniale. Inoltre, il mondo è pieno di fonti di carbonio (legno degli alberi) che sono adatte alla combustione. Tutto ciò ci indica che il fuoco e i materiali che lo appiccano e lo mantengono sono stati creati apposta per soddisfare la vita umana. Nel Corano, Allah parla al genere umano usando queste parole:
Egli è Colui che nell'albero verde ha posto per voi un fuoco con cui accendete. (Surah Ya-sin: 80)
L’utilizzo dell’ossigeno da parte del corpo dipende principalmente dalla proprietà di questo gas di dissolversi nell’acqua. L’ossigeno che entra nei nostri polmoni quando inspiriamo viene dissolto immediatamente nel sangue. La proteina chiamata emoglobina cattura le molecole di ossigeno e le trasporta alle altre cellule del corpo in cui, grazie allo speciale sistema di enzimi menzionato in precedenza, l’ossigeno viene utilizzato per ossidare i composti di carbonio chiamati ATP per sprigionare energia.
È così che tutti gli organismi complessi ricavano la loro energia. Tuttavia, l’operazione di questo sistema dipende specialmente dalla solubilità dell’ossigeno. Se l’ossigeno non fosse sufficientemente solubile, non ne entrerebbe abbastanza nel flusso sanguigno e le cellule non sarebbero in grado di generare l’energia necessaria; se invece l’ossigeno fosse troppo solubile, ve ne sarebbe un eccesso nel sangue che provocherebbe una tossicità da ossigeno.
La differenza di solubilità nell’acqua dei diversi gas si calcola in termini di un milione. Cioè, il gas più solubile è un milione di volte più solubile in acqua di quello meno solubile in assoluto ed esistono anche gas che possiedono la stessa identica solubilità. L’anidride carbonica, ad esempio, è circa venti volte più solubile in acqua dell’ossigeno. All’interno della vasta gamma di potenziali solubilità, quella posseduta dall’ossigeno è proprio quella più si adatta alle esigenze della vita umana.
Cosa accadrebbe se la percentuale di solubilità in acqua dell’ossigeno fosse diversa: minore o maggiore?
Analizziamo la prima ipotesi. Se l’ossigeno fosse meno solubile in acqua (e quindi anche nel sangue) nel flusso sanguigno ne circolerebbe di meno e le cellule del corpo ne sarebbero prive. Ciò renderebbe la vita molto più difficile per agli organismi metabolicamente attivi come gli esseri umani. A prescindere dagli sforzi compiuti per respirare, si correrebbe sempre il pericolo di soffocare a causa della carenza di ossigeno nelle cellule del corpo.
Se, invece, la solubilità in acqua dell’ossigeno fosse maggiore si andrebbe incontro alla minaccia della tossicità da ossigeno cui si faceva riferimento prima. L’ossigeno, difatti, è una sostanza alquanto pericolosa: se un organismo ne ottiene troppo, il risultato può essere fatale. Parte dell’ossigeno nel sangue entra in reazione chimica con l’acqua del sangue. Se la quantità di ossigeno dissolto aumenta troppo, si produrranno sottoprodotti altamente reattivi e pericolosi. Una delle funzioni del complesso sistema di enzimi del sangue è di prevenire che ciò accada. Ma se la quantità di ossigeno dissolto aumentasse troppo, gli enzimi non potrebbero svolgere il loro compito. Di conseguenza, ogni respiro ci avvelenerebbe sempre di più, fino a portarci alla morte. A tal proposito il chimico Irwin Fridovich commenta:
Tutti gli organismi che respirano vengono catturati in una trappola crudele. Lo stesso ossigeno che sostiene le loro vite risulta loro tossico ed essi sopravvivono a stento, solo per virtù degli elaborati meccanismi di difesa.97
Ciò che ci salva da questa trappola (dall’essere avvelenati da troppo ossigeno o, in sua mancanza, dal finire soffocati) è il fatto che la solubilità dell’ossigeno e il complesso sistema enzimatico del corpo sono stati accuratamente concepiti per essere così come sono. Più esplicitamente, Allah ha creato non solo l’aria che respiriamo ma anche il sistema che ne rende possibile l’utilizzo in perfetta armonia.
Naturalmente il carbonio e l’ossigeno non sono i soli elementi che sono stati creati apposta per rendere possibile la vita. Anche l’idrogeno e l’azoto, che costituiscono gran parte dei corpi degli esseri viventi, possiedono caratteristiche che rendono possibile la vita. Infatti, pare che tutti gli elementi della tavola periodica svolgano un ruolo a sostegno della vita.
Nella tavola periodica vi sono novantadue elementi: dall’idrogeno, il più leggero, all’uranio, il più pesante (naturalemente oltre l’uranio esistono altri elementi ma non sono presenti in natura, essendo tutti stati creati in laboratorio, e nessuno di loro è stabile). Di questi novantadue elementi, venticinque sono direttamente coinvolti nella vita e, di questi, undici (idrogeno, carbonio, azoto, sodio, magnesio, fosforo, zolfo, cloro, potassio e calcio) costituiscono da soli il 99% del peso corporeo di quasi tutti gli esseri viventi. Gli altri quattordici elementi (vanadio, cromo, manganese, ferro, cobalto, nichel, rame, zinco, molibdeno, boro, silicio, fluoro e iodio) sono presenti negli organismi viventi solo in piccole quantità, ma anch’essi svolgono funzioni di vitale importanza. In alcuni esseri viventi sono presenti tre elementi che svolgono funzioni di non chiara comprensione (arsenio, stagno e tungsteno). Altri tre elementi (bromo, stronzio e bario) sono presenti in molti organismi, ma le loro funzioni rimangono ancora un mistero.98
Questo ampio spettro comprende atomi di ognuna delle diverse serie della tavola periodica i cui elementi sono disposti in base alle caratteristiche degli atomi. Ciò indica che, in un modo o nell’altro, tutti i gruppi di elementi della tavola periodica sono necessari per la vita. In The Biological Chemistry of the Elements, J. J. R Frausto da Silva e R. J. P Williams affermano:
Pare che, in pratica, gli elementi biologici siano stati selezionati da tutti i gruppi e sottogruppi della tavola periodica… e ciò significa che, in pratica, tutti i tipi di proprietà chimiche sono associati ai processi di vita entro i limiti imposti dalle costrizioni ambientali.99
Anche gli elementi radioattivi pesanti alla fine della tavola periodica sono stati predisposti al servizio della vita umana. In Nature's Destiny, Michael Denton descrive nei particolari il ruolo essenziale che questi elementi radioattivi (come l’uranio) svolgono nella formazione della struttura geologica della Terra. La radioattività, presente in natura, è associata al fatto che il nucleo della Terra è in grado di trattenere il suo calore. È proprio questo calore che mantiene liquido il nucleo (costituito da ferro e nichel). Questo nucleo liquido è la fonte del campo magnetico della Terra che, come già osservato, aiuta a proteggere il pianeta dalle radiazioni pericolose e dalle particelle dello spazio svolgendo, in contemporanea, altre funzioni. Anche i gas inerti e i metalli poco presenti sul nostro pianeta, che sembrano non essere coinvolti nel mantenimento della vita, esistono per assicurare che la gamma di elementi presenti in natura si estenda fino all’uranio.100
In pratica, è opportuno dire che tutti gli elementi a noi conosciuti svolgono una qualche funzione per la vita umana. Nessuno di loro è superfluo o inutile. Questa è un’ulteriore prova che l’universo è stato creato da Allah per l’umanità.
Ogni proprietà fisica e chimica dell’universo qui esaminata risulta esattamente quella più adatta per consentire alla vita di esistere. E in questo libro ci siamo limitati a trattare solo superficialmente la prova schiacciante di questo fatto. Qualsiasi tipo di ricerca si conduca, l’osservazione generale è che ogni particolare dell’universo possiede uno scopo utile per la vita umana e che ogni particolare è stato appositamente concepito, bilanciato e armonizzato per raggiungere tale finalità.
Di sicuro ciò rappresenta la prova dell’esistenza di un Creatore supremo che ha dato vita all’universo per questo scopo. Qualsiasi proprietà della materia si esamini, si finirà per constatare l’infinita conoscenza, saggezza e potere di Allah che ha creato l’universo dal nulla. Ogni cosa si inchina alla sua volontà ed è questa la ragione per cui tutto è in armonia perfetta con il resto.

Questa è la conclusione cui è infine arrivata la scienza del XX secolo. Si tratta della consapevolezza di un fatto presentato all’umanità nel Corano già quattordici secoli fa; Allah ha creato ogni particolare dell’universo per rivelare la perfezione della Sua creazione:
Benedetto Colui nella Cui mano è la sovranità, Egli è onnipotente; Colui Che ha creato la morte e la vita per mettere alla prova chi di voi meglio opera, Egli è l'Eccelso, il Perdonatore; Colui Che ha creato sette cieli sovrapposti senza che tu veda alcun difetto nella creazione del Compassionevole. Osserva, vedi una qualche fenditura? Osserva ancora due volte: il tuo sguardo ricadrà, stanco e sfinito. (Surat al-Mulk: 1-4)
84 "Science Finds God", Newsweek, 27 July 1998
85 Robert E. D. Clark, The Universe: Plan or Accident?, London, Paternoster Press, 1961, p. 98
86 Fred Hoyle, Religion and the Scientists, London: SCM, 1959; M. A. Corey, The Natural History of Creation, Maryland: University Press of America, 1995, p. 341
87 David Burnie, Life, Eyewitess Science, London: Dorling Kindersley, 1996, p. 8
88 Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1. Oxford: Oxford University Press, 1950, p. 490
89 Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1., p. 490
90 J. B. S. Haldane, "The Origin of Life", New Biology, 1954, vol. 16, p. 12
91 Michael Denton, Nature's Destiny, p. 115-116
92 Lawrence Henderson, The Fitness of the Environment, Boston: Beacon Press, 1958, p. 247-48
93 L. L. Ingraham, "Enzymic Activation of Oxygen", Comprehensive Biochemistry, (ed. M. Florkin, E. H. Stotz), Amsterdam: Elsevier, vol. 14, p. 424
94 La questione di come sia nato il complicato sistema enzimatico che consente l’assunzione di ossigeno da parte del sistema circolatorio è uno di quegli argomenti che la teoria dell’evoluzione non riesce a spiegare. Questo sistema possiede una complessità irriducibile, in altre parole, il sistema non può funzionare salvo che tutti i suoi componenti funzionino perfettamente. Per questa ragione non ha senso dire che il sistema si sia sviluppato da una forma semplice a una più complessa, come suggerisce l’evoluzione. In proposito il prof. Ali Demirsoy, biologo presso L’Università Hacettepe di Ankara e sostenitore della teoria dell’evoluzione in Turchia, ammette quanto segue:
"Tuttavia, ci ritroviamo di fronte a un problema. I mitocondri sfruttano un numero fisso di enzimi durante il processo di rottura (con l’ossigeno). L’assenza di solo uno di questi enzimi blocca il funzionamento dell’intero sistema. Inoltre, l’energia ottenuta con l’ossigeno non sembra essere un sistema che possa procedere un passo alla volta. Solo il sistema completo svolge la sua funzione. Ecco il motivo per cui, invece di uno sviluppo passo dopo passo al quale abbiamo aderito come principio, sentiamo il desiderio di sposare l’idea che tutti gli enzimi (enzimi di Krebs) necessari a innescare le reazioni dei mitocondri sono entrati all’interno della cellula casualmente o sono state formate in quella cellula all’improvviso. E questo semplicemente perché quei sistemi che non sono riusciti a sfruttare appieno l’ossigeno, in altre parole quei sistemi che restano nel livello intermedio, sparirebbero nella reazione con l’ossigeno” (Ali Demirsoy, The Basic Laws of Life: General Zoology, Volume 1, Section 1, Ankara, 1998, p.578)
Mentre la probabilità della formazione di uno solo degli enzimi (proteine speciali) di cui il sopracitato prof. Demirsoy afferma "dobbiamo accettare che si sono formate all’improvviso e per caso” è di una su 10950, è di certo insensato avanzare l’ipotesi che molti enzimi di quel genere si siano formati per caso.
95 Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1. Oxford: Oxford University Press, 1950, p. 490
96 Michael Denton, Nature's Destiny, p. 122-123 
97 Irwin Fridovich, "Oxygen Radicals, Hydrogen Peroxide, and Oxygen Toxicity", Free Radicals in Biology, (ed. W. A. Pryor), New York: Academic Press, 1976, p. 239-240
98 J. J. R. Fraústo da Silva, R. J. P. Williams, The Biological Chemistry of the Elements, Oxford: Oxford University Press, p. 3-4
99 J. J. R. Fraústo da Silva, R. J. P. Williams, The Biological Chemistry of the Elements, p. 5