Ada pemikiran dan tujuan dibalik alam semesta. Ada isyarat kehadiran Tuhan dalam betapa abstraknya ilmu matematika menembus rahasia alam semesta, yang mengisyaratkan adanya sebuah pemikiran rasional menciptakan dunia ini. Alam disesuaikan untuk memungkinkan kehidupan dan kesadaran agar muncul. John Polkinghorne, British Physicist 84
 |
Sampai pada bab ini, kita telah mengamati betapa semua keseim-bangan fisik alam semesta tempat kita hidup telah dirancang seca-ra khusus sehingga kita bisa hidup. Kita telah melihat betapa struktur umum alam semesta ini, lokasi bumi di alam semesta, dan faktor-faktor seperti udara, cahaya, dan air telah dirancang secara tepat untuk memiliki sifat yang kita butuhkan. Di samping semua itu, kita juga perlu mencermati unsur-unsur yang menyusun tubuh kita. Unsur-unsur kimia tersebut, unsur pembentuk tangan, mata, rambut, dan organ-organ kita, seperti halnya semua makhluk hidup—tanaman dan binatang—yang merupakan sumber makanan kita, telah dirancang secara khusus untuk memenuhi tujuan mereka semestinya.
Fisikawan Robert E. D. Clark merujuk pada keberadaan rancangan khusus dan luar biasa dalam unsur pembentuk kehidupan ketika dia berkata: “Seolah Sang Pencipta telah memberi kita seperangkat bagian-bagian pracetak yang dibuat siap untuk bekerja.” 85
Di antara unsur-unsur pembentuk, karbon adalah unsur yang paling penting.
 |
| Salah satu bentuk alamiah karbon murni adalah grafit. Namun, unsur ini mampu membentuk zat-zat yang sangat berbeda jika bergabung dengan atom-atom unsur lain. Struktur utama tubuh manusia merupakan hasil ikatan kimia berbeda-beda yang mampu dibentuk karbon. |
Pada bab sebelumnya kita menjelaskan proses yang luar biasa di mana karbon, unsur yang menduduki posisi keenam dalam tabel periodik, dihasilkan dalam pusat bintang yang sangat besar, yang disebut raksasa merah. Kita juga melihat bagaimana, setelah menemukan proses yang menarik ini, Fred Hoyle tergerak untuk mengatakan bahwa “hukum fisika nuklir telah dirancang secara sengaja dengan ber-dasar pada konsekuensi yang dihasilkan pada bintang.”86
Kalau kita mengamati karbon dengan lebih teliti, kita dapat melihat bahwa tidak hanya su-sunan fisik unsur ini saja namun juga sifat kimianya dirancang secara sengaja agar menjadi seperti seharusnya.
Karbon murni secara alamiah terjadi dalam dua bentuk: grafit dan berlian. Tetapi karbon juga membentuk senyawa dengan bermacam unsur lain dan hasilnya adalah berbagai jenis zat yang berbeda. Secara khusus benda organik kehidupan yang begitu beragam—membran sel dan kulit kayu, lensa mata dan tanduk rusa, bagian putih telur dan racun ular—semuanya tersusun oleh senyawa-senyawa yang berdasar karbon. Karbon, dicampur dengan hidrogen, oksigen, dan nitrogen dalam bera-gam jumlah dan susunan geometrik, menghasilkan begitu beragam materi dengan sifat-sifat yang jauh berbeda.
Beberapa molekul senyawa karbon mengandung hanya beberapa atom, yang lain mengandung ratusan atau bahkan jutaan atom. Lebih jauh lagi, tidak ada unsur lain yang memiliki manfaat seberagam karbon dalam pembentukan molekul dengan daya tahan dan stabilitas seperti itu. Mengutip pendapat David Burnie dalam bukunya yang berjudul Life:
Karbon merupakan unsur yang sangat tidak biasa. Tanpa adanya karbon dan sifat tidak biasanya, sepertinya tidak akan ada kehidupan di bumi. 87
Mengenai karbon, ahli kimia Inggris, Nevil Sidgwick, menulis dalam buku Chemical Elements and Their Compounds:
Karbon merupakan unsur unik dalam jumlah dan ragam senyawa yang dapat dibentuknya. Seperempat juta lebih telah diisolasikan dan dijelaskan, namun memberikan ide yang sangat tidak sempurna akan kekuatannya, karena karbon merupakan dasar dari semua benda hidup . 88
Baik ditinjau dari sisi fisika atau kimia, tidak mungkin kehidupan berdasarkan pada unsur selain karbon. Pada suatu saat, silikon dikemu-kakan sebagai unsur lain yang mungkin sebagai dasar kehidupan. Na-mun sekarang kita tahu bahwa dugaan ini tidak mungkin. Mengutip pendapat Sidgwick lagi:
Sekarang kami cukup tahu untuk meyakini bahwa ide akan sebuah dunia di mana silikon mengambil alih fungsi karbon sebagai dasar kehidupan tidaklah mungkin..... 89
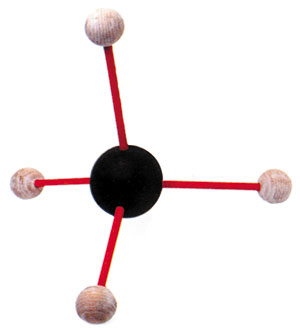 |
| Struktur metana: empat atom hidrogen membagi setiap satu elektron dengan sebuah atom karbon. |
Ikatan kimia yang mengikat karbon ketika membentuk senyawa or-ganik disebut “ikatan kovalen”. Ikatan kovalen terjadi ketika dua atom berbagi elektronnya.
Elektron-elektron sebuah atom menempati lapisan orbit spesifik yang mengelilingi inti atom. Orbit yang terdekat dengan nukleus dapat ditempati tidak lebih dari dua elektron. Pada orbit berikutnya elektron terbanyak adalah delapan elektron. Pada orbit ketiga, dapat mencapai delapan belas. Jumlah elektron semakin meningkat dengan penambahan orbit. Lalu, sebuah aspek yang menarik dari skema tersebut adalah atom “ingin” melengkapi jumlah elektron dalam orbit. Misalnya, oksigen memiliki enam elektron pada orbit kedua (dan yang paling luar), dan ini membuatnya lebih “berani” membentuk kombinasi dengan atom lain-nya yang akan menyediakan dua kelebihan elektron yang diperlukan untuk menaikkan jumlahnya menjadi delapan. (Kenapa atom bertindak seperti itu adalah sebuah pertanyaan yang tidak terjawab. Namun dengan berperilaku seperti itu merupakan hal yang bagus: karena jika tidak, kehidupan tidak akan mungkin.)
Ikatan kovalen merupakan hasil dari kecenderungan atom untuk melengkapi elektron pada orbitnya. Dua atau lebih atom dapat mengisi kekurangan dalam orbitnya dengan saling berbagi elektron. Sebuah contoh yang bagus adalah molekul air (H2O), yang unsur pembentuknya (dua atom hidrogen dan satu atom oksigen) membentuk ikatan kovalen. Dalam senyawa ini, oksigen melengkapi jumlah elektron pada orbit kedua menjadi delapan dengan berbagi dua elektron (masing-masing satu elektron) dari orbit dua buah atom hidrogen; dengan cara yang sama, setiap atom hidrogen “meminjam” satu elektron dari atom oksigen untuk melengkapi kulitnya sendiri.
Karbon sangat piawai dalam membentuk ikatan kovalen dengan atom lain (termasuk atom karbon) yang memungkinkan terbentuknya sejumlah besar senyawa. Salah satu contoh dari senyawa ini yang paling sederhana adalah metana: gas biasa yang dibentuk dari ikatan kovalen empat atom hidrogen dan satu atom karbon. Hanya dengan enam elek-tron, orbit terluar karbon kekurangan empat elektron untuk menggenap-kan menjadi delapan, tidak seperti oksigen yang kekurangan dua, dan karena inilah, empat atom hidrogen diperlukan untuk melengkapinya.
Telah disebutkan bahwa karbon memiliki beragam kemampuan dalam membentuk ikatan dengan atom lain dan kemampuan inilah yang menghasilkan beragam senyawa. Kelompok senyawa yang dibentuk secara eksklusif dari karbon dan hidrogen disebut “hidrokarbon”. Kelompok ini merupakan kelompok senyawa yang sangat beragam yang meliputi gas alam, bensin, kero-sen, dan minyak oli. Hidrokar-bon seperti etilen dan propilen adalah dasar pembentuk in-dustri petrokimia modern. Hidrokarbon seperti benze-na, toluena, dan terpentin tidak asing lagi bagi siapa pun yang kerjanya berhu-bungan dengan cat. Naptalen yang melindungi pakaian kita dari ngengat adalah hidrokarbon lainnya. Dengan tambahan klorin da-lam senyawa, beberapa hidrokarbon menjadi zat bius; dengan tambahan florin, kita memiliki freon, gas yang banyak digunakan dalam AC.
Terdapat kelompok senyawa penting lain bentukan dari karbon, hi-drogen, dan oksigen yang berikatan kovalen satu dengan lainnya. Dalam kelom-pok ini kita temukan alkohol seperti etanol dan propanol, keton, aldehid, dan asam lemak, sebagai salah satu dari sekian banyak senyawa. Kelompok senyawa lain yang tersusun dari karbon, hidrogen, dan oksi-gen adalah gula, yang mencakup glukosa dan fruktosa.
Selulosa yang menyusun kerangka kayu dan bahan kertas mentah adalah karbohidrat. Begitu juga dengan cuka. Demikian pula lilin lebah dan asam formiat. Setiap senyawa dan bahan-bahan yang begitu beragam yang terbentuk alami di dunia kita ini “tidak lebih” merupakan susunan berbeda dari karbon, hidrogen, dan oksigen yang diikat ber-sama oleh ikatan kovalen.
Ketika karbon, hidrogen, oksigen, dan nitrogen membentuk ikatan seperti itu, hasilnya adalah sekelompok molekul yang merupakan dasar dan struktur kehidupan itu sendiri: asam amino yang menyusun protein. Nukleotida yang menyusun DNA juga merupakan molekul yang di-bentuk dari karbon, hidrogen, oksigen, dan nitrogen.
Singkatnya, ikatan kovalen yang mampu dibentuk oleh atom karbon sangat penting untuk keberadaan kehidupan. Andaikan hidrogen, kar-bon, nitrogen, dan oksigen tidak terlalu “berani” saling berbagi elektron, maka kehidupan tidak akan mungkin.
Yang memungkinkan karbon membentuk ikatan-ikatan tersebut adalah sebuah sifat yang disebut para ahli kimia sebagai “keadaan meta-stabil”, sebuah keadaan dengan ambang yang sangat tipis di atas stabil. Ahli biokimia, J. B. S. Haldane, menjelaskan keadaan metastabil sebagai:
Molekul metastabil berarti molekul yang mampu melepaskan energi bebas dengan transformasi, namun cukup stabil untuk bertahan lama kecuali diaktifkan oleh panas, radiasi, atau penyatuan dengan katalis.90
 |
| Minyak zaitun, daging, dan gula merah: Segala sesuatu yang kita makan terbuat dari susunan hirogen, oksigen, dan karbon dengan penambahan atom lain seperti nitrogen. |
Istilah yang agak teknis ini berarti bahwa karbon memiliki struktur agak unik, oleh karenanya, sangat mudah bagi karbon membentuk ikatan kovalen dalam kondisi normal.
Akan tetapi, tepat di sinilah karbon mulai membuat penasaran ka-rena karbon metastabil hanya dalam kisaran suhu yang sangat sempit. Lebih tepatnya, senyawa karbon menjadi sangat tidak stabil jika suhu di atas 100°C.
Air Dan Metana: Dua Contoh Ikatan Kovalen Yang Berbeda |
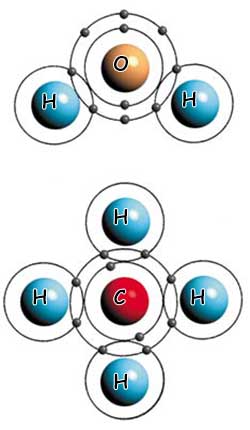 |
| Dalam molekul air (atas), terdapat ikatan kovalen antara dua atom hidrogen dan satu atom oksigen. Dalam molekul metana (bawah), empat atom hidrogen membentuk ikatan kovalen dengan sebuah atom karbon. |
Fakta ini sangat lumrah dalam kehidupan kita sehari-hari sehingga sebagian besar dari kita tidak menganggapnya istimewa. Misalnya ketika kita memasak daging, yang kita lakukan sebenarnya adalah mengubah struktur senyawa karbonnya. Namun ada sesuatu yang perlu kita catat di sini: Daging matang menjadi benar-benar “mati”; yaitu struktur kimianya berbeda dengan yang dimiliki daging tersebut ketika masih merupakan bagian organisme hidup. Sesungguhnya sebagian besar senyawa karbon menjadi “tidak alami” pada suhu di atas 100°C: sebagian besar vitamin misalnya, terurai begitu saja; gula juga mengalami perubahan struktur dan kehilangan sebagian nilai gizi; dan pada suhu sekitar 150°C, senyawa karbon akan mulai terbakar.
Dengan kata lain, jika atom karbon harus melakukan ikatan kovalen dengan atom-atom lain dan jika senyawa yang dihasilkan harus tetap stabil, maka suhu lingkungan ha-rus tidak lebih dari 100°C. Seba-liknya batas bawah adalah sekitar 0°C: Jika suhu turun jauh di ba-wah 0°C, biokimia organik men-jadi tidak mungkin.
Dalam kasus senyawa lain, secara umum keadaan ini bukan-lah yang terjadi. Sebagian besar senyawa anorganik tidak meta-stabil; kestabilannya tidak terlalu dipengaruhi oleh perubahan su-hu. Untuk mengetahuinya mari kita lakukan sebuah percobaan. Tusuk sepotong daging di ujung sebatang logam panjang, misal-nya besi dan panaskan keduanya di atas api. Bersamaan suhu me-manas, daging akan menghitam dan akhirnya terbakar jauh sebe-lum terjadi apa-apa dengan logam tersebut. Hal yang sama akan terjadi juga jika Anda meng-ganti logam dengan batu atau kaca. Anda harus meningkatkan panas sampai beberapa ratus derajat sebelum struktur benda-benda tersebut berubah.
Saat ini, Anda tentu sudah mendapati kesamaan antara kisaran suhu yang diperlukan untuk pembentukan dan kestabilan ikatan kovalen se-nyawa karbon dan kisaran suhu yang umum pada planet kita. Seperti telah dibahas di bagian lain, di seluruh alam semesta, suhu berkisar dari jutaan derajat dalam pusat bintang sampai nol derajat mutlak (-273,15°C). Namun bumi, yang telah diciptakan untuk umat manusia agar hidup di dalamnya, memiliki kisaran suhu sempit yang mutlak diperlukan bagi pembentukan senyawa karbon sebagai unsur pembentuk kehidupan.
Namun “kebetulan” yang menarik tidak berakhir di sini. Kisaran suhu yang sama merupakan satu-satunya keadaan di mana air tetap cair. Seperti yang telah kita bahas pada bab sebelumnya, air yang cair meru-pakan salah satu syarat utama kehidupan, untuk tetap cair, air memerlu-kan suhu yang tepat sama dengan suhu senyawa karbon agar dapat ter-bentuk dan stabil. Tidak ada “hukum” fisika atau alam yang mengha-ruskan keadaan seperti ini, dan berdasarkan fakta ini, terbukti bahwa sifat fisik air dan karbon dan keadaan planet bumi diciptakan selaras antara satu dan lainnya.
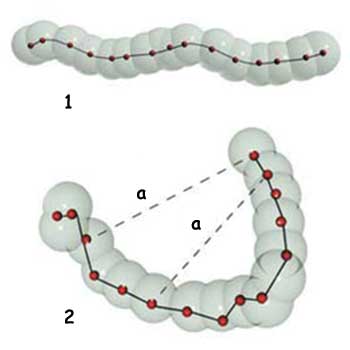 |
| 1. Ikatan Kovalen: Atom secara kuat diikat ke atom lain 2. Ikatan yang lemah: sebuah senyawa organik dibentuk dalam sebuah struktur tiga dimensi oleh ikatan (garis putus) yang lemah (ikatan non-kovalen) |
| a. Ikatan yang lemah |
Ikatan kovalen bukan satu-satunya bentuk ikatan kimia yang men-jaga kestabilan senyawa-senyawa bagi kehidupan. Terdapat jenis ikatan lain dan berbeda yang dikenal sebagai “ikatan lemah”.
Ikatan ini sekitar dua puluh kali lebih lemah daripada ikatan kovalen, dari sinilah asal namanya; namun ikatan tersebut tidak kurang penting bagi proses-proses kimia organik. Berkat ikatan yang lemah ini, protein yang membangun unsur pembentuk makhluk hidup mampu menjaga struktur tiga dimensi yang rumit dan sangat vital.
Untuk menerangkannya, kita harus membahas secara ringkas struk-tur protein. Protein biasanya digambarkan sebagai sebuah “rantai” asam amino. Pada dasarnya pengandaian ini benar, namun tidak lengkap. Pengandaian ini tidak lengkap, karena bagi kebanyakan orang sebuah “rantai asam amino” dibayangkan sebagai suatu untaian mutiara sedang-kan asam amino yang menyusun protein memiliki struktur tiga dimensi yang lebih menyerupai sebatang pohon dengan cabang-cabang berdaun.
Ikatan kovalen adalah ikatan yang menahan atom-atom asam amino untuk bersatu. Ikatan yang lemah adalah ikatan yang menjaga struktur tiga dimensi yang penting dari asam-asam tersebut. Tidak ada protein bisa bertahan tanpa ikatan yang lemah ini. Dan tentu saja tanpa protein, tidak akan ada kehidupan.
Sekarang yang menarik dari masalah ini adalah bahwa kisaran suhu yang memungkinkan ikatan lemah terbentuk sama dengan kisaran suhu yang terdapat di bumi. Hal ini agak aneh karena sifat fisik maupun kimia ikatan kovalen versus ikatan lemah merupakan hal yang sangat berbeda dan saling tidak berhubungan. Dengan kata lain, tidak ada alasan menga-pa ikatan-ikatan tersebut memerlukan kisaran suhu yang sama. Namun begitulah kedua ikatan tersebut: Kedua tipe ikatan tersebut hanya dapat terbentuk dan tetap stabil dalam kisaran suhu yang sempit itu. Andaikan tidak—andaikan ikatan kovalen memerlukan kisaran suhu yang sangat berbeda dari ikatan yang lemah, misalnya—maka ikatan tersebut tidak akan mungkin membentuk struktur tiga dimensi rumit yang dibutuhkan protein.
Segala sesuatu yang telah kita ketahui tentang keluarbiasaan sifat-sifat kimia atom karbon menunjukkan bahwa terdapat keselarasan di an-tara unsur ini, yang merupakan pembentuk dasar kehidupan, air yang juga penting bagi kehidupan, dan planet bumi yang merupakan tempat bernaung kehidupan tersebut. Dalam Nature's Destiny, Michael Denton menekankan keselarasan ini ketika mengatakan:
Dari kisaran suhu yang sangat besar di alam semesta, hanya terdapat satu pita sempit suhu yang didalamnya kita memiliki (1) air yang cair, (2) senyawa organik metastabil yang melimpah, dan (3) ikatan lemah untuk menstabilkan struktur tiga dimensi molekul yang rumit. 91
Dari seluruh benda di ruang angkasa yang kita amati, “pita sempit suhu” ini hanya ada di bumi. Demikian pula, hanya di bumi, dua pem-bentuk dasar kehidupan—karbon dan air—ditemukan dalam persediaan melimpah.
Semua itu menunjukkan bahwa atom karbon beserta sifat-sifat luar biasanya dirancang secara khusus untuk kehidupan dan bahwa planet kita diciptakan untuk menjadi tempat tinggal bagi kehidupan berbasis karbon.
Kita telah mengetahui bagaimana karbon merupakan unsur pem-bentuk makhluk hidup yang paling penting dan bagaimana karbon diran-cang secara khusus untuk memenuhi fungsi tersebut. Tetapi keber-adaan semua bentuk kehidupan berbasis karbon mutlak bergantung pada hal kedua: energi. Energi adalah kebutuhan yang mutlak bagi kehidupan.
Tanaman hijau memperoleh energi mereka dari matahari melalui proses fotosintesis. Bagi makhluk hidup lain di bumi—termasuk kita—satu-satunya sumber energi adalah sebuah proses yang disebut “oksida-si”—kata keren dari “pembakaran”. Energi organisme penghirup oksigen diperoleh dari pembakaran makanan yang berasal dari tumbuhan dan binatang. Seperti yang Anda tebak dari istilah “oksidasi”, pembakaran tersebut merupakan reaksi kimia yang menjadikan zat-zat teroksidasi —dengan kata lain, zat-zat digabungkan dengan oksigen. Karena itulah oksigen sama mutlaknya bagi kehidupan seperti karbon dan hidrogen.
Rumus umum pembakaran (oksidasi) adalah sebagai berikut:
senyawa karbon + oksigen ---> air + karbon dioksida + energi
Artinya bahwa ketika senyawa karbon dan oksigen bergabung (tentu di bawah kondisi yang tepat), sebuah reaksi berlangsung sehingga meng-hasilkan air dan karbon dioksida dan melepaskan energi yang besar. Reaksi ini paling mudah terjadi pada hidrokarbon (senyawa hidrogen dan karbon). Glukosa (sejenis gula yang juga hidrokarbon) adalah senyawa yang secara tetap dibakar dalam tubuh Anda untuk menjaga agar tubuh tetap mendapat pasokan energi.
Begitulah, hidrogen dan karbon yang menyusun hidrokarbon me-rupakan unsur yang paling sesuai untuk berlangsungnya oksidasi. Di antara semua atom lainnya, hidrogen paling mudah bergabung dengan oksigen dan melepaskan energi paling banyak dalam proses tersebut. Jika Anda memerlukan bahan bakar untuk membakar dalam oksigen, Anda tidak dapat menemukan yang lebih baik daripada hidrogen. Dari nilainya sebagai bahan bakar, karbon berada di urutan ketiga setelah hidrogen dan boron. Dalam buku The Fitness of the Environment, Lawrence Henderson mengomentari kesesuaian luar biasa yang tampak di sini:
Reaksi-reaksi kimia (tersebut di atas), yang karena banyak alasan lain tampak paling sesuai untuk proses fisiologi, ternyata merupakan reaksi yang mampu mengalirkan energi melimpah ke dalam arus kehidupan. 92
 |
Sebagaimana kita ketahui, reaksi dasar yang melepaskan energi yang diperlukan bagi kelangsungan organisme penghirup oksigen adalah oksi-dasi hidrokarbon. Tetapi fakta sederhana ini menimbulkan pertanyaan menyulitkan: Jika tubuh kita tersusun terutama oleh hidrokarbon, me-ngapa hidrokarbon dalam tubuh tidak teroksidasi juga? Dengan kata lain, mengapa kita tidak langsung terbakar, seperti korek api digesekkan?
Tubuh kita secara terus-menerus berhubungan dengan oksigen da-lam udara namun tidak teroksidasi: tubuh tidak terbakar. Mengapa tidak?
Alasan bagi keadaan yang bertolak belakang ini adalah bahwa di bawah suhu dan tekanan normal, oksigen dalam bentuk molekul (O2) memiliki tingkat kelembaman (keengganan) atau “nobilitas” yang besar. (Arti dalam istilah kimia, “nobilitas” adalah keengganan atau ketidak-mampuan sebuah zat untuk melakukan reaksi kimia dengan zat lain). Na-mun hal ini menimbulkan pertanyaan lain. Jika molekul oksigen begitu “enggan” sampai menghindar dari membakar kita, bagaimana molekul yang sama berhasil melakukan reaksi kimia di dalam tubuh kita?
Jawaban untuk pertanyaan ini, yang membingungkan para ahli ki-mia pada awal abad ke-19, tidak diketahui sampai pertengahan kedua abad ke-20, ketika para peneliti biokimia menemukan keberadaan enzim dalam tubuh manusia yang berfungsi hanya untuk memaksa O2 di atmos-fer untuk memasuki reaksi kimia. Sebagai hasil serangkaian langkah yang sangat rumit, enzim tersebut menggunakan atom besi dan tembaga dalam tubuh kita sebagai katalis. Katalis adalah senyawa yang memulai sebuah reaksi kimia dan memungkinkan reaksi tersebut berlanjut dalam keadaan berbeda (misalnya suhu yang lebih rendah, dan lain-lain) yang mestinya tidak mungkin apabila tanpa katalis. 93
Dengan kata lain, terdapat hal yang sangat menarik: Oksigen meru-pakan unsur yang mendukung oksidasi dan pembakaran, dan wajar orang berharap oksigen akan membakar kita juga. Untuk mencegahnya, bentuk molekul O2 oksigen yang ada di atmosfer diberi sifat kelembaman kimia yang kuat. Karena itulah oksigen tidak mudah bereaksi. Namun di lain sisi, tubuh kita bergantung pada sifat pem-bakaran oksigen untuk energi tubuh dan karena alasan itulah sel-sel kita dilengkapi dengan sis-tem enzim yang sangat rumit yang membuat gas “enggan” tersebut sangat reaktif.
Selagi dalam bahasan ini, perlu ditunjukkan pula bahwa sistem en-zim merupakan contoh rancangan yang begitu mengagumkan sehingga teori evolusi yang menyatakan bahwa kehidupan muncul kebetulan tidak akan pernah mampu menjelaskannya. 94
Terdapat pencegahan lain agar tubuh kita tidak terbakar, yang dise-but ahli kimia Nevil Sidgwick sebagai “sifat kelembaman karbon”.95
Artinya, karbon tidak terlalu mudah juga dalam bereaksi dengan oksigen di bawah tekanan dan suhu normal. Dijelaskan dengan bahasa kimia, semua ini tampak agak sulit dimengerti, namun sebetulnya yang akan digambarkan di sini adalah sesuatu yang pasti sudah diketahui siapa pun yang pernah menyalakan perapian dengan tumpukan kayu atau tungku batubara pada musim dingin atau mengadakan barbecue pada musim panas. Agar api mulai menyala, Anda harus menyiapkan banyak perlengkapan (bahan bakar, pemantik dan lain-lain) atau meningkatkan dengan tiba-ti-ba suhu bahan bakar sampai derajat sangat tinggi (seperti dengan obor). Tetapi sekali bahan bakar itu terbakar, karbon di dalamnya bereaksi de-ngan oksigen dengan cepat dan energi dilepas-kan dalam jumlah besar. Itulah sebabnya sangat sulit menyalakan api tanpa sumber panas lain. Namun setelah pembakaran dimulai, panas yang tinggi dihasilkan dan menyebabkan senya-wa karbon lain yang terdekat ikut terbakar sehingga api menyebar.
Jika kita mencermati masalah ini, kita dapat melihat bahwa api itu sendiri adalah contoh rancangan paling menarik. Sifat kimia oksigen dan karbon telah dirancang sedemikan rupa sehingga kedua unsur ter-sebut saling bereaksi (pembakaran) hanya ketika terdapat panas tinggi. Ini juga bagus karena jika sebaliknya, kehidupan di planet ini tidak akan menyenangkan atau bahkan tidak mungkin. Andaikan oksigen dan kar-bon hanya sedikit lebih mudah saling bereaksi, pembakaran spontan — penyalaan dengan sendirinya — dari manusia, pohon, dan binatang akan menjadi kejadian yang lumrah ketika cuaca terlalu hangat. Misalnya, se-orang yang berjalan melalui gurun bisa secara tiba-tiba terbakar di siang hari sangat terik; tanaman dan binatang akan dihadapkan pada risiko yang sama. Bahkan andaikan kehidupan mungkin ada dalam dunia seperti itu, benar-benar tidak akan menyenangkan.
Sebaliknya, andaikan karbon dan oksigen sedikit lebih lembam (yaitu agak kurang reaktif) dari sekarang ini, akan lebih sulit menyalakan api: bahkan mungkin mustahil. Dan tanpa api, kita bukan saja tak mampu menjaga tubuh tetap hangat: besar kemungkinan bahwa tidak akan ada kemajuan teknologi di planet kita, karena kemajuan tersebut bergantung pada kemampuan mengolah bahan-bahan seperti logam; dan tanpa pa-nas yang disediakan oleh api, pemurnian dan pengolahan logam menjadi mustahil.
Semua hal tersebut menunjukkan bahwa sifat-sifat kimia karbon dan oksigen disusun agar sangat sesuai bagi kebutuhan umat manusia. Berke-naan dengan hal ini, Michael Denton mengatakan:
Ketidak-reaktifan atom karbon dan oksigen pada suhu lingkungan, diga-bungkan dengan energi sangat besar yang dilepaskan begitu pembakaran dimulai, benar-benar cocok bagi kehidupan di bumi. Kombinasi aneh ini tidak hanya menyediakan energi melimpah bagi kehidupan tingkat tinggi dari ok-sidasi yang terkendali dan teratur, namun juga memungkinkan penggunaan api terkendali oleh umat manusia, serta memungkinkan pe-manfaatan energi pembakaran yang melimpah bagi kemajuan teknologi. 96
Dengan kata lain, karbon dan oksigen telah diciptakan dengan sifat-sifat yang paling sesuai untuk kehidupan manusia. Sifat-sifat kedua un-sur ini memungkinkan kita menyalakan api dan memanfaatkannya se-nyaman mungkin. Lebih jauh lagi, dunia penuh dengan sumber karbon (misalnya kayu) yang sesuai bagi pembakaran. Semua itu merupakan petunjuk bahwa api dan bahan-bahan untuk memulai dan memper-tahankannya diciptakan khusus sesuai bagi kehidupan manusia. Dalam Al Quran, Allah berfirman kepada umat manusia:
Tuhan yang menjadikan untukmu api dari kayu yang hijau, maka tiba-tiba kamu nyalakan (api) dari kayu itu. (QS. Yaasiin, 36: 80)
Penggunaan oksigen oleh tubuh sangat bergantung pada sifat gas un-tuk larut dalam air. Oksigen yang masuk ke dalam paru-paru kita saat kita menarik napas segera dilarutkan dalam darah. Protein yang disebut he-moglobin menangkap molekul-molekul oksigen dan membawanya ke sel tubuh lainnya di mana, berkat sistem enzim khusus yang dijelaskan sebelumnya, oksigen digunakan untuk mengoksidasi senyawa karbon yang disebut ATP untuk melepaskan energinya.
Semua organisme kompleks memperoleh energi mereka dengan cara ini. Tetapi operasi sistem ini bergantung terutama pada daya larut ok-sigen. Jika oksigen tidak cukup larut, oksigen yang akan memasuki darah dan sel tidak akan cukup dan tidak akan bisa menghasilkan energi yang mereka butuhkan; di lain sisi, jika oksigen sangat larut, darah akan kele-bihan oksigen dan menyebabkan kondisi yang dikenal sebagai keracunan oksigen.
Perbedaan daya larut dalam air dari gas yang berbeda bervariasi de-ngan faktor mencapai sejuta. Yaitu, gas yang paling mudah larut sejuta kali lebih gampang terlarut dalam air daripada gas yang paling tidak mudah larut, dan sangat sulit menemukan gas-gas dengan daya larut sama. Misalnya, karbon dioksida larut dua puluh kali lebih mudah dalam air daripada oksigen. Tetapi di antara kisaran daya larut yang mungkin dimiliki, daya larut oksigen benar-benar sesuai untuk kebutuhan kehi-dupan manusia.
Apa yang akan terjadi jika daya larut oksigen dalam air berbeda: sedikit lebih rendah atau sedikit lebih tinggi?
Mari kita cermati kemungkinan pertama. Jika oksigen kurang larut dalam air (dan juga dalam darah), oksigen yang masuk ke aliran darah hanya sedikit dan sel-sel tubuh akan kekurangan oksigen. Ini akan mem-buat kehidupan sangat sulit bagi organisme bermetabolisme aktif seperti manusia. Betapapun hebatnya Anda bernapas, Anda secara terus-mene-rus akan menghadapi bahaya mati lemas karena tidak cukup oksigen yang sampai ke dalam sel-sel tubuh Anda.
Sebaliknya, jika daya larut oksigen dalam air lebih tinggi, Anda akan dihadapkan pada ancaman keracunan oksigen, yang dijelaskan di atas. Sebetulnya, oksigen merupakan zat yang berbahaya: Jika sebuah organis-me mendapatkan terlalu banyak oksigen, akibatnya bisa fatal. Sebagian oksigen dalam darah bereaksi dengan air darah. Jika jumlah oksigen yang terlarut terlalu tinggi, maka dihasilkan zat yang sangat reaktif dan merusak. Salah satu fungsi sistem enzim darah yang rumit adalah untuk mencegah keracunan itu terjadi. Namun jika jumlah oksigen terlarut terlalu tinggi, enzim tersebut tidak bisa mengerjakan tugasnya. Sebagai akibatnya, setiap napas yang kita hirup akan meracuni kita dan meng-akibatkan kematian dengan cepat. Ahli kimia, Irwin Fridovich mengo-mentari masalah ini:
Semua organisme yang bernapas terjebak dalam perangkap berbahaya. Oksigen yang mendukung kehidupannya justru racun bagi mereka, dan mereka bertahan hidup di bawah ancaman bahaya, hanya dengan ber-gantung pada mekanisme pertahanan yang rumit. 97
Yang menyelamatkan kita dari perangkap ini—dari keracunan akibat terlalu banyak oksigen atau dari kematian yang disebabkan tidak cukup-nya oksigen merupakan fakta bahwa daya larut oksigen dan sistem enzim yang rumit dari tubuh telah dirancang secara cermat dan diciptakan seba-gaimana seharusnya. Gamblangnya, Allah tidak hanya telah mencipta-kan udara yang kita hirup, namun juga sistem yang memungkinkan menggunakan udara itu dalam keselarasan sempurna dengan yang lainnya.
 |
| Cooper |
Karbon dan oksigen tentu saja bukan satu-satunya unsur yang diran-cang dengan sengaja untuk memungkinkan kehidupan. Unsur-unsur seperti hidrogen dan nitrogen, yang menyusun sebagian besar tubuh makhluk hidup, juga memiliki sifat-sifat yang memungkinkan kehi-dupan. Kenyataannya, tidak terdapat satu pun unsur dalam tabel perio-dik yang tidak berperan dalam mendukung kehidupan.
Dalam tabel periodik dasar terdapat sembilan puluh dua unsur mulai dari hidrogen (paling ringan) sampai uranium (paling berat). (Tentu saja terdapat unsur-unsur lain di luar uranium, namun unsur-unsur tersebut tidak terbentuk secara alamiah dan semuanya dibuat dalam kondisi laboratorium. Tidak satu pun dari unsur-unsur tersebut stabil). Dari kesembilan puluh dua unsur tersebut, dua puluh lima di antaranya secara langsung berperan penting untuk kehidupan, dan di antaranya, hanya sebelas – hidrogen, karbon, oksigen, nitrogen, sodium, magnesium, fosfor, belerang, klorin, potasium, dan kalsium—yang menyusun sekitar 99% berat badan hampir semua jenis makhluk hidup. Empat belas unsur lainnya (vanadium, kromium, mangan, besi, kobalt, nikel, tembaga, seng, molibdenum, boron, silikon, selenium, flurin, dan iodin) muncul dalam organisme kehidupan hanya dalam jumlah yang sangat kecil, meskipun begitu unsur-unsur tersebut memiliki fungsi-fungsi yang sangat penting. Tiga unsur—arsenik, timah, dan tungsten—ditemukan pada beberapa makhluk hidup di mana unsur-unsur tersebut melakukan fungsi yang tidak bisa benar-benar dipahami. Tiga unsur lain—bromin, strontium, dan barium— diketahui terdapat pada kebanyakan organisme, tetapi fungsi-fungsinya masih merupakan misteri. 98
 |
| Magnesium |
Spektrum lebar ini mencakup atom-atom dari setiap rangkaian yang berbeda pada tabel periodik, yang unsur-unsurnya dikelompokkan ber-dasarkan sifat-sifat atomnya. Ini menunjukkan bahwa seluruh kelompok unsur dalam tabel periodik penting untuk kehidupan, dengan cara bagai-manapun. Dalam buku The Biological Chemistry of the Elements, J. J. R. Frausto da Silva dan R. J. P. William mengatakan bahwa:
Unsur-unsur biologi tampaknya telah diseleksi dari hampir semua kelompok dan subkelompok tabel periodik... dan ini berarti bahwa hampir semua jenis sifat kimia berkaitan dengan proses kehidupan dalam batasan-batasan yang ditentukan oleh lingkungan.99
Bahkan unsur radioaktif berat pada bagian akhir tabel periodik telah dirancang untuk berperan bagi kehidupan manusia. Dalam buku Nature's Destiny, Michael Denton menggambarkan secara terperinci peran penting yang dimainkan unsur-unsur radioaktif, seperti uranium, dalam pemben-tukan struktur geologis bumi. Radioaktif alamiah sangat berkaitan de-ngan kenyataan bahwa inti bumi mampu mempertahankan panasnya. Panas tersebut menahan inti, yang terdiri dari besi dan nikel, agar tetap cair. Inti cair ini merupakan sumber medan magnet bumi yang, seperti telah diterangkan di bagian lain, membantu melindungi planet dari radi-asi dan partikel berbahaya dari luar angkasa, di samping melakukan fungsi-fungsi lain. Bahkan gas dan unsur lembam seperti logam-logam rare-earth, yang tampaknya tidak satu pun mendukung kehidupan, jelas ada disebabkan oleh tuntutan untuk memastikan bahwa rangkaian unsur bentukan-alami hanya sampai pada uranium. 100
Singkatnya, bisa dikatakan bahwa semua unsur yang kita ketahui keberadaannya memiliki suatu peran bagi kehidupan manusia. Tidak satu pun dari unsur-unsur tersebut yang keberadaannya berlebihan ataupun tidak bertujuan. Situasi ini merupakan bukti lebih jauh bahwa alam semesta ini diciptakan oleh Allah untuk umat manusia.
 |
| Allah summons us to investigate and reflect upon the heavens, alternation of the night and the day, and the Creation of universe. Science is a method by which we discover the Creation of Allah. |
Setiap sifat fisik dan kimia alam semesta yang telah kita kaji ternyata tepat sesuai dengan yang diperlukan bagi keberadaan kehidupan. Na-mun, dalam buku ini kita hanya mengorek permukaan dari bukti yang berlimpah untuk fakta tersebut. Betapapun dalamnya Anda menyelidiki detail atau memperluas penelitian, pengamatan umum ini tetap berlaku; dalam setiap detail alam semesta, ada satu tujuan demi kehidupan manu-sia, dan setiap detail dirancang secara sempurna, seimbang, dan harmonis untuk mencapai tujuan itu.
Tentu saja ini merupakan bukti keberadaan Sang Pencipta yang men-jadikan alam semesta untuk tujuan ini. Apa pun sifat materi yang kita kaji, kita menyaksikan di dalamnya pengetahuan, kebijaksanaan, dan kekua-tan tidak terbatas dari Sang Pencipta. Allah menciptakan benda-benda tersebut dari ketiadaan. Setiap benda tunduk pada kehendak-Nya, dan itulah sebabnya setiap dan segala sesuatu berada dalam keharmonisan yang sempurna satu sama lain.
Inilah kesimpulan yang akhirnya dicapai ilmu pengetahuan abad ke-20. Meskipun demikian, ini merupakan sekadar pengakuan terhadap fakta yang telah dipaparkan Al Quran empat belas abad lalu kepada umat manusia: Allah telah menciptakan setiap detail alam semesta untuk menampakkan kesempurnaan ciptaan-Nya sendiri:
“Maha suci Allah yang ditangan-Nyalah segala kerajaan, dan Dia Maha Kuasa atas segala sesuatu. Yang telah menciptakan tujuh langit berlapis-lapis. Kamu sekali-kali tidak melihat pada ciptaan Tuhan Yang Maha Pemurah sesuatu yang tidak seimbang. Maka lihatlah berulang-ulang, adakah kamu lihat sesuatu yang tidak seimbang? Kemudian pandanglah sekali lagi niscaya penglihatan-mu akan kembali kepadamu dengan tidak menemukan sesuatu cacat dan penglihatanmu itupun dalam keadaan payah.” (QS. Al Mulk, 67: 1-4)
84. "Science Finds God", Newsweek, 27 Temmuz 1998
85. Robert E. D. Clark, The Universe: Plan or Accident?, London, Paternoster Press, 1961, s. 98
86. Fred Hoyle, Religion and the Scientists, London: SCM, 1959; M. A. Corey, The Natural History of Creation, Maryland: University Press of America, 1995, s. 341
87. David Burnie, Life, Eyewitess Science, London: Dorling Kindersley, 1996, s. 8
88. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1. Oxford: Oxford University Press, 1950, s. 490
89. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1., s. 490
90. J. B. S. Haldane, "The Origin of Life", New Biology, 1954, vol. 16, s. 12
91. Michael Denton, Nature's Destiny, s. 115-116
92. Lawrence Henderson, The Fitness of the Environment, Boston: Beacon Press, 1958, s. 247-48
93. L. L. Ingraham, "Enzymic Activation of Oxygen", Comprehensive Biochemistry, (ed. M. Florkin, E. H. Stotz), Amsterdam: Elsevier, vol. 14, s. 424
94. Oksijen solunumunu sağlayan kompleks enzim sisteminin nasıl ortaya çıktığı sorusu, evrim teorisinin açıklayamadığı sayısız sorulardan biridir. Bu enzim sisteminin özelliği, ancak eksiksiz çalışması halinde işe yaramasıdır, dolayısıyla daha basite indirgenemez. Bu nedenle de evrimin iddia ettiği gibi basitten karmaşığa doğru bir gelişim izlediği öne sürülemez. Türkiye'nin en önde gelen evrim savunucularının başında gelen Hacettepe Üniversitesi biyoloğu Prof. Ali Demirsoy, bu konuda şu itirafı yapmaktadır:
"Yalnız, burada henüz çözülemeyen bir sorun vardır. Mitokondriler bu (oksijenli) parçalamaları gerçekleştirirken belirli sayıda enzim kullanırlar. Bu enzimlerin bir tanesinin eksikliği tüm sistemin durmasına neden olur. Ayrıca oksijenli enerji kazanımı, kademe kademe gelişecek bir sistem olarak da görünmemektedir. Tümü, ancak bir işlev sistemi oluşturur. Bu nedenle buraya kadar ilke olarak savunduğumuz kademe kademe gelişme yerine, ister istemez, çok az bir olasılık da olsa, mitokondrilerin oksijenli tepkimelerini yürütecek tüm enzimlerin (Krebs enzimleri) bir defada, bir rastlantı sonucu bir hücreye girdiğini ya da bir defada o hücre içinde oluştuğunu kabul etmek zorundayız. Çünkü oksijeni tam olarak kullanamayan, yani ara kademede kalan tüm sistemler, oksijenle temas edince yok olacaktı. (Ali Demirsoy, Yaşamın Temel Kuralları: Genel Biyoloji, Genel Zooloji, cilt 1, kısım 1, Ankara, 1998, s. 578)
Ali Demirsoy'un "hepsinin bir anda tesadüfen oluştuğunu kabul etmek zorundayız"dediği enzimlerin (özel proteinlerin) tek birinin tesadüfen oluşma şansı bile 10950'de 1'lik ihtimallerde iken, yani imkansızken, bu tip çok sayıda enzimin tesadüfen oluştuğunu öne sürmek, elbette ki akıl dışıdır.
95. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1. Oxford: Oxford University Press, 1950, s. 490
96. Michael Denton, Nature's Destiny, s. 122-123
97. Irwin Fridovich, "Oxygen Radicals, Hydrogen Peroxide, and Oxygen Toxicity", Free Radicals in Biology, (ed. W. A. Pryor), New York: Academic Press, 1976, s. 239-240
98. J. J. R. Fraústo da Silva, R. J. P. Williams, The Biological Chemistry of the Elements, Oxford: Oxford University Press, s. 3-4
99. J. J. R. Fraústo da Silva, R. J. P. Williams, The Biological Chemistry of the Elements, s. 5
100. Michael Denton, Nature's Destiny, s. 79-85