Como trasfondo del universo hay una inteligencia y un propósito. Las matemáticas abstractas, al adentrarse en los secretos del universo, dan indicios de esa presencia divina, pues sugieren que un entendimiento racional creó el mundo.
La naturaleza está calibrada, sintonizada con precisión para permitir que emerja la vida y la conciencia.
John Polkinghorne. Físico Británico84
Hasta aquí hemos examinado cómo han sido diseñados especialmente, para que podamos vivir, todos esos equilibrios físicos del universo que habitamos.
Hemos visto como la estructura general de este universo, la ubicación de la Tierra en el mismo y factores como el aire, la luz y el agua, han sido determinados específicamente para tener exactamente los atributos que nosotros, como seres vivientes, requerimos.
Además de eso, sin embargo, también necesitamos considerar los elementos que conforman nuestro cuerpo. Esos elementos químicos, los »ladrillos« de nuestras manos, ojos, pelo y órganos, —que también forman parte de todos los demás seres vivientes (plantas y animales) que nos sirven de alimento—, han sido perfilados particularmente para servir a propósitos precisos.
El físico Robert E. D. Clark se refiere al designio superior y especial existente en los »ladrillos« de la vida cuando dice: »Es como si el Creador nos ha dado servido un conjunto de cosas o partes prefabricadas listas para funcionar«85.
El más importante de esos »ladrillos« es el carbono.
En capítulos anteriores hemos descrito el extraordinario proceso por medio del cual el carbono, el elemento que ocupa el sexto lugar en la tabla periódica, fue producido en lo más profundo de las grandes estrellas llamadas »gigantes rojas«. Hemos visto como, habiendo descubierto ese proceso maravilloso, Fred Hoyle se vio impulsado a decir que »las leyes de la física nuclear han sido diseñadas deliberadamente con respecto a las consecuencias que tienen al interior de las estrellas«86.
Cuando examinamos el carbono con más atención, podemos ver que no sólo la constitución física del mismo sino también sus propiedades químicas fueron establecidas deliberadamente para que sean lo que son.

El grafito es una forma natural de carbono. Este elemento es capaz de formar una variedad extraordinaria de sustancias distintas cuando se combina con los átomos de otros elementos. La estructura principal del cuerpo humano es el resultado de la distintas uniones químicas en las que es capaz de participar el carbono.
El carbono puro se presenta solamente de dos maneras: como grafito o como diamante. Sin embargo, el carbono también entra en combinación con muchos otros elementos, lo que da lugar a nuevos tipos de substancias.
En particular, es con compuestos de carbono que se forma la increíble variedad de substancias orgánicas fundamentales, como ser la membrana de la célula, la corteza del árbol, el cristalino del ojo, el cuerno del ciervo, la albúmina del huevo y el veneno de la víbora.
El carbono combinado con el hidrógeno, el oxígeno y el nitrógeno, en muy distintas cantidades y disposiciones geométricas, resulta en una vasta clasificación de substancias con propiedades muy distintas.
Algunas moléculas de compuestos de carbono consisten de unos pocos átomos; otras contienen miles de millones. Por otra parte, ningún otro elemento es tan versátil como el carbono para la formación de moléculas muy durables y estables.
Citamos de Vida, el libro de David Burnie:
»El carbono es un elemento muy excepcional. Sin su presencia y sin sus propiedades extraordinarias, es improbable que la vida estuviese en la Tierra«87
En Los Elementos Químicos y Sus Compuestos, escribe respecto al carbono el químico británico Nevil Sidgwick:
»El carbono es único entre los elementos en lo que hace a la cantidad y variedad de compuestos que puede formar.Ya han sido aislados y descritos más de un cuarto de millón, pero este solo dato da una idea muy imperfecta de sus atributos, dado que es la base de todas las formas de vida«88.
Por razones tanto físicas como químicas, es imposible que la vida se base en cualquier otro elemento distinto al carbono. En una ocasión se propuso la silicona como un sustituto en el que se podría basar la vida. Sin embargo, ahora sabemos que esa presunción es imposible.
Citemos nuevamente a Sidgwick:
»Ahora conocemos lo suficiente como para estar seguros de que es imposible la idea de un mundo en el que la silicona fuese a tomar el lugar del carbono como elemento principal de la vida…«89.
Los enlaces químicos en los que entra el carbono cuando forma compuestos orgánicos son llamados »enlaces covalentes«. Se dice que ocurre un enlace covalente cuando dos átomos comparten sus electrones.
Los electrones de un átomo ocupan órbitas especiales alrededor del núcleo (orbitales atómicos cerrados, cuya forma depende del valor de lo que se denomina »número cuántico l«).
La órbita más cercana al núcleo puede ser ocupada por no más de dos electrones. En la órbita siguiente es posible un máximo de ocho electrones. En la tercera órbita puede haber hasta dieciocho.
El número de electrones continúa aumentando con el agregado de más órbitas. Un aspecto interesante de este esquema es que parece que los átomos »quieren« completar el número de electrones en sus orbitales cerrados.
El oxígeno, por ejemplo, tiene seis electrones en su segunda órbita (la exterior), lo que lo hace »ávido« por entrar en combinación con otros átomos que le proveerán los otros dos electrones necesarios para incrementar su número a ocho.(Porqué los átomos se comportan así, es una pregunta aún sin respuesta. Pero lo que hacen es algo bueno: si no lo harían, no sería posible la vida).
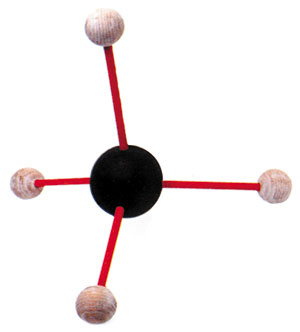
La estructura del metano: cuatro átomos de hidrógeno comparten un electrón cada uno con un solo átomo de carbono.
Los enlaces covalentes son el resultado de esta tendencia de los átomos a completar sus orbitales cerrados. A menudo dos o más átomos pueden cubrir la escasez por medio de compartir electrones entre sí.
Un buen ejemplo es la molécula de agua (H20), cuyos »ladrillos« (dos átomos de hidrógeno y uno de oxígeno) forman un enlace covalente. En este compuesto, el oxígeno completa los ocho electrones en la segunda órbita por medio de compartir los dos electrones (uno cada uno) ubicados en los orbitales cerrados de los dos átomos de hidrógeno.
De la misma manera, cada átomo de hidrógeno »toma prestado« un electrón del oxígeno para completar sus propios orbitales cerrados.
El carbono es muy bueno para formar enlaces covalentes con otros átomos (que incluyen átomos de carbono), a partir de lo cual se puede hacer una enorme cantidad de distintos compuestos.
Uno de los más simples de ellos es el metano: un gas común que se forma a partir del enlace covalente de cuatro átomos de hidrógeno y un átomo de carbono. El orbital externo cerrado del carbono con sólo seis electrones, no llega a los ocho que necesita —el oxígeno necesita solamente dos—, razón por la que hacen falta cuatro átomos de hidrógeno para completarlo.
Dijimos que el carbono era especialmente versátil para formar enlaces con otros átomos y que ello hace posible una enorme cantidad de compuestos distintos.
La clase de compuestos formados exclusivamente con carbono e hidrógeno se llama »hidrocarburos«. Se trata de una gran familia de compuestos que incluye el gas natural, el petróleo líquido, el kerosene y los aceites lubricantes.
Hidrocarburos como el etileno y el propileno son »la piedra fundamental« sobre la que se ha erigido la industria petroquímica moderna. Hidrocarburos como el benceno, el tolueno y la trementina son familiares a cualquiera que trabaja con pinturas.
La naftalina que nos protege las ropas de las polillas, es otro hidrocarburo. Añadiéndole cloro a su composición, algunos hidrocarburos se convierten en anestésicos. Con la adición de flúor tenemos freon, un gas que es ampliamente usado en la refrigeración.
Hay otra importante clase de compuestos en que el carbono, el hidrógeno y el oxígeno forman enlaces covalentes entre sí. En esta familia encontramos alcoholes como el etanol y el propanol, las cetonas, los aldehidos y los ácidos grasos, entre muchísimas otras substancias. Otro grupo de compuestos formado por el carbono, el hidrógeno y el oxígeno, está integrado por los azúcares, incluidas la glucosa y la fructosa.
La celulosa, que hace a la formación de la madera y es la materia prima para el papel, es un carbohidrato. Como el vinagre, el ácido fórmico y la cera de abejas.
Cada una de la increíble panoplia de substancias y materiales que se dan naturalmente en nuestro mundo, no es »nada más« que una disposición, una ubicación distinta del carbono, del hidrógeno y del oxígeno vinculados entre sí por el enlace covalente.

Aceite de oliva, carne y azúcar moreno: todo lo que comemos está hecho de hidrógeno, oxígeno y carbono ordenados de distintas maneras, con la adición de átomos de otros elementos, como el nitrógeno.
Cuando los últimos elementos mencionados y el nitrógeno forman esos enlaces, el resultado es una clase de molécula que resulta el fundamento y la estructura de la propia vida: el aminoácido que forma las proteínas.
Los nucleótidos que forman el ADN también son moléculas hechas de carbono, hidrógeno, oxígeno y nitrógeno.
En resumen, los enlaces covalentes en que es capaz de entrar el átomo de carbono, son esenciales para la existencia de la vida. Donde el hidrógeno, el carbono, el nitrógeno y el oxígeno no están »ansiosos« por compartir electrones entre sí, sería imposible la vida.
Lo que hace posible que el carbono forme esos enlaces es una propiedad que los químicos llaman »metaestabilidad«, es decir, la característica de poseer un margen adecuado de estabilidad para un propósito práctico.
El bioquímico J. B. S. Haldane describe así la metaestabilidad:
»Una molécula metaestable significa que la misma puede liberar energía por medio de una transformación y es lo suficientemente estable para permanecer por un largo tiempo, a menos que sea tratada con calor, radiación o unida con un catalizador«90.
Lo que significa esta definición de tipo técnica, es que el carbono tiene una estructura más bien singular gracias a la cual le es muy fácil entrar en enlaces covalentes bajo condiciones normales.
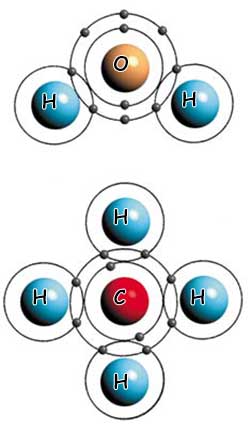
EL AGUA Y EL METANO : DOS EJEMPLOS DISTINTOS DE ENLACES COVALENTES
IEn la molécula de agua (arriba) hay un enlace covalente entre los dos átomos de hidrógeno y el átomo de oxígeno. En la molécula de metano (abajo), cuatro átomos de hidrógeno forman enlaces covalentes con un solo átomo de carbono.
Pero es aquí donde, precisamente, la situación empieza a convertirse en curiosa, porque el carbono es metaestable solamente en una escala de temperatura muy estrecha. Específicamente, los compuestos de carbono se vuelven muy inestables cuando la temperatura supera los 100°C.
Esto nos resulta tan común hoy día, que la mayoría de nosotros lo considera una cosa normal. Por ejemplo, cuando se cocina carne, lo que en realidad se hace es cambiar la estructura de sus compuestos de carbono.
Pero aquí hay algo que debemos tener en cuenta: la carne cocida se ha vuelto completamente »muerta«, es decir, su estructura química es distinta a la que tenía cuando formaba parte de un organismo vivo.
En realidad, la mayoría de los compuestos de carbono se »desnaturalizan« a temperaturas superiores a 100°C. Por ejemplo, la mayoría de las vitaminas simplemente se desintegran a esa temperatura.
Los azúcares también sufren cambios estructurales y pierden algunos de sus valores nutritivos. Y alrededor de los 150°C los compuestos de carbono empiezan a quemarse.
En otras palabras, si los átomos de carbono van a entrar en enlaces covalentes con otros átomos y si los compuestos resultantes van a permanecer estables, la temperatura ambiente no debe superar los 100°C. El límite más bajo, por otra parte, está alrededor de 0°C: si la temperatura se reduce mucho más, se convierte en imposible la química orgánica.
En el caso de otros compuestos no es esa la situación general. La mayoría de los compuestos inorgánicos no son metaestables, es decir, su estabilidad no se ve muy afectada por los cambios térmicos.
Para ver esto hagamos un experimento. En el extremo de una pieza de metal que puede ser de hierro, coloquemos un pedazo de carne y calentémoslos al fuego.
Al aumentar la temperatura la carne se oscurecerá y eventualmente se quemará mucho antes que al hierro le suceda algo. Lo mismo sucederá si éste es sustituido por una piedra o un vidrio.La temperatura tiene que aumentar muchos cientos de grados antes de que la estructura de estos materiales comiencen a modificarse.
Seguramente el lector se habrá dado cuenta de la similitud existente entre: a) la escala de temperatura necesaria para que los enlaces covalentes de los compuestos de carbono se establezcan y permanezcan estables; y b) la escala de temperatura que prevalece en nuestro planeta.
Como hemos dicho antes, la escala de temperaturas en todo el universo va desde millones de grados centígrados en el corazón de las estrellas, al cero absoluto (–273,15°C).
Pero la Tierra, al haber sido creada para que la humanidad viva en ella, posee en muchísimas de sus distintas partes la estrecha escala de temperatura esencial para la formación de los compuestos de carbono que son los »ladrillos« de la vida.
Pero las »coincidencias« curiosas no terminan aquí. Ese mismo intervalo de temperatura es el único en el que el agua puede permanecer líquida. Como vimos en capítulos anteriores, el agua líquida es uno de los requerimientos básicos de la vida y, con el objeto de permanecer en esa condición, requiere, precisamente, las mismas temperaturas que necesitan los compuestos de carbono para formarse y ser estables.
No existe ninguna »ley« natural o física que dicte que esto debería ser así, circunstancia que evidencia que las propiedades físicas del agua y del carbono, así como todas las condiciones de la Tierra, fueron creadas para permanecer armónicas.
Los enlaces covalentes no son los únicos que mantienen estables los compuestos de la vida. Hay otra categoría distinta de enlace conocida como »enlaces débiles«.
Son unas veinte veces más débiles que los enlaces covalentes y de aquí su nombre. Pero no son menos cruciales para el proceso de la química orgánica. Es gracias al enlace débil que las proteínas que integran los »ladrillos« de lo viviente son capaces de mantener sus complejas estructuras tridimensionales (3-D), de importancia fundamental.
Para explicar esto tenemos que hablar brevemente de la estructura de las proteínas. A éstas se las menciona generalmente como una »cadena« de aminoácidos.
Aunque esta metáfora es esencialmente correcta, es incompleta. Y lo es porque a la mayoría de la gente una »cadena de aminoácidos« le hace pensar en algo como una sarta de perlas o argollas. Pero los aminoácidos que forman las proteínas tienen una estructura 3-D más parecida a un árbol con ramas y hojas.
Los enlaces covalentes son los que mantienen juntos a los átomos de aminoácidos. Los enlaces débiles son los que mantienen la estructura esencial 3-D de los aminoácidos.Sin esos enlaces débiles no podría existir ninguna proteína. Y por supuesto, sin proteínas no podría haber ningún tipo de vida.
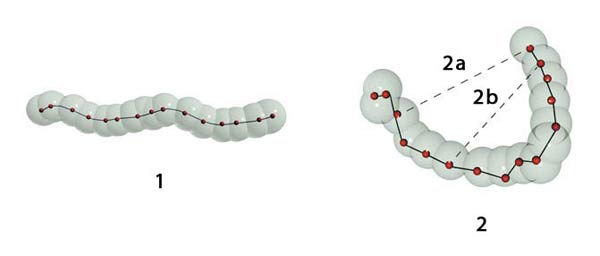
1. Enlaces covalentes: Los átomos están vinculados fuertemente entre sí.
2. Enlaces débiles: Un compuesto orgánico se mantiene en una forma tridimensional singular por medio de enlaces débiles (no covalentes) (líneas entrecortadas).
2a. Enlace débil, 2b.Enlace débil.
Lo interesante de esta cuestión es que la escala de temperaturas en la que los enlaces débiles son capaces de cumplir sus funciones, es la misma que prevalece en la Tierra.
Esto es algo más bien extraordinario porque las naturalezas física y química de los enlaces covalentes y de los enlaces débiles son totalmente diferentes e independientes.
En otras palabras, no existe ninguna razón intrínseca debido a la cual ambos tipos de enlaces deberían requerir la misma escala de temperatura. No obstante, eso es lo que sucede: ambos tipos de enlaces sólo se pueden formar y permanecer estables dentro de esa estrecha escala de temperaturas. Y si ello no hubiese sido posible —si los enlaces covalentes hubiesen requerido una escala de temperatura desatinadamente distinta a la de los enlaces débiles— entonces habría sido imposible construir las complejas estructuras 3-D que requieren las proteínas.
Todo lo que hemos visto respecto a las extraordinarias propiedades químicas de los átomos de carbono, muestra que existe una inmensa armonía entre los siguientes elementos: la proteína, que es un »ladrillo« fundamental de la vida; el agua, que también es vital para la vida; la Tierra, que es el refugio para esa vida. Michael Denton subraya en Destino de la Naturaleza dicha aptitud cuando dice:
»De la enorme escala de temperaturas en el cosmos, solamente en una banda diminuta de la misma tenemos: (1) agua líquida, (2) gran abundancia de compuestos orgánicos metaestables, (3) enlaces débiles para estabilizar la forma 3-D de las moléculas complejas«91.
De entre todos los cuerpos celestes observados, esa »banda diminuta de temperatura« existe solamente en la Tierra. Además, es sólo en la Tierra que otros dos »ladrillos« fundamentales de la vida —el carbono y el agua— se pueden encontrar en tan generosa proporción.
Hemos visto que el carbono es el »ladrillo« más importante de los organismos vivos y cómo fue especialmente diseñado para llevar a cabo su función. La existencia de todas las formas de vida basadas en el carbono, sin embargo, depende de un segundo imperativo: la energía, un requerimiento indispensable para la vida.
Los vegetales toman su energía del sol a través del proceso de la fotosíntesis. Para el resto de las criaturas vivientes —en las que nos incluimos— la única fuente de energía resulta de un proceso llamado »oxidación«, término con el que se expresa la existencia de »combustión«.
La energía de los organismos que respiran oxígeno se deriva de la combustión de los nutrientes que toman de los vegetales y animales. Como se puede colegir del término »oxidación«, esa combustión es una reacción química en que las substancias (o nutrientes) son oxidadas, es decir, se combinan con el oxígeno. A esto se debe que el oxígeno sea tan fundamental para la vida como lo son el carbono y el hidrógeno.
Una fórmula general de »combustión« (oxidación) sería la siguiente:
Compuesto de carbono + oxígeno > agua + dióxido de carbono + energía
Esto significa que cuando se combinan los compuestos de carbono y el oxígeno (por supuesto, en las condiciones apropiadas), tiene lugar una reacción que genera agua y dióxido de carbono, lo cual, a su vez, libera una considerable cantidad de energía.
Dicha reacción sucede más rápidamente en los hidrocarburos (compuestos de hidrógeno y carbono). En el cuerpo lo que se quema constantemente para mantener la provisión de energía es la glucosa (un azúcar y también un hidrocarburo).
Los elementos hidrógeno y carbono que forman los hidrocarburos, son los más aptos para la oxidación que tiene lugar. De entre todos los átomos, el hidrógeno es el que se combina más rápidamente con el carbono y da lugar a la liberación de la mayor parte de energía en el proceso.
Si se requiere un material para quemar en el oxígeno, no se puede encontrar nada mejor que el hidrógeno. Desde el punto de vista de su valor como combustible, el carbono se ubica en tercer lugar después del hidrógeno y el boro.
Lawrence Henderson comenta en La Adecuación del Medio Ambiente la extraordinaria adaptabilidad que encierra esto:
»Los cambios químicos, que por muchas otras razones parecen ser los más aptos para dar lugar a los procesos fisiológicos, vienen a ser los que pasan el flujo más grande de energía a la corriente de la vida«92.
Como ya dijimos, la reacción fundamental que libera la energía necesaria para que sigan viviendo los organismos que respiran oxígeno es la oxidación de los hidrocarburos. Pero este simple hecho plantea una pregunta preocupante: si el cuerpo está hecho esencialmente de hidrocarburos, ¿por qué no nos oxidamos casi por completo?
O para decirlo de otra manera, ¿por qué no nos incendiamos como un fósforo encendido?
Nuestros cuerpos están constantemente en contacto con el oxígeno del aire y no obstante no se oxidan: no se prenden fuego. ¿Por qué?
La razón para ello, que parece una paradoja, es que bajo condiciones normales de temperatura y presión, la forma molecular del oxígeno (O2) es en gran medida inerte, tiene un grado substancial de »nobleza«.
(Los químicos consideran esa »nobleza« como la renuencia —o incapacidad— de una substancia para entrar en reacción química con otras). Pero esto plantea otro interrogante: si el oxígeno molecular es tan »noble« como para evitar que nos incineremos, ¿cómo es que esta misma molécula está hecha para entrar en reacciones químicas en el interior de nuestros cuerpos?
La respuesta a esta pregunta, que ya tenía perplejo a los químicos a mediados del siglo XIX, no se pudo conocer hasta la segunda mitad del siglo XX, cuando los investigadores bioquímicos descubrieron la existencia de enzimas en el cuerpo humano, cuya únicas función era forzar al O2 en la atmósfera a entrar en reacciones químicas.
Como resultado de una serie de pasos extremadamente complejos, esas enzimas utilizan en nuestros cuerpos los átomos de hierro y cobre como catalizadores. Un catalizador es una substancia que inicia una reacción química y le permite que prosiga bajo distintas condiciones (como las bajas temperaturas, etc.). Sin ese catalizador la reacción sería imposible93.
En otras palabras, nos encontramos aquí con una situación interesante: si el oxígeno sustenta la oxidación y la combustión, sería normal que también nos quememos por completo.
Justamente, para evitar eso, a la forma molecular O2 que existe en la atmósfera se le ha dado una gran nobleza química. Es decir, no entra fácilmente en reacciones.
Pero, por otra parte, para la obtención de la energía necesaria, nuestros cuerpos dependen de la propiedad oxidante del oxígeno. Por esa razón las células han sido equipadas con una enzima sumamente compleja que hace al gas en cuestión extremadamente reactivo.
Ya que estamos en el tema deberíamos señalar también que dicho sistema enzimático es un ejemplo maravilloso de designio. Y ninguna teoría evolucionista defensora de que la vida se desarrolló como resultado de sucesos casuales puede tener la esperanza de explicarlo94.

Pero también se ha tomado otra precaución para que el cuerpo no se queme entero: se trata de lo que el químico británico Nevil Sidgwick llama "característica de falta de actividad del carbono«95.
Esto significa que el carbono no tiene demasiada prisa por entrar en reacción con el oxígeno bajo temperaturas y presiones normales. Expresado en el lenguaje de la química, todo esto puede parecer más bien misterioso, pero, simplemente, lo que se está diciendo es algo que ya conoce cualquiera que alguna vez tuvo que prender en invierno la estufa llena de grandes leños o un horno de carbón, o el fuego para el asado.
Con el objeto que el fuego se encienda y se mantenga, hay que tomar algunas medidas (iniciar la ignición, hacer que se extienda, etc.), e incluso elevar rápidamente la temperatura del combustible (cosa que se puede hacer con un soplete).
Pero una vez que el combustible comienza a quemarse, el carbono que contiene entra en reacción con el oxígeno de manera rápida, liberándose una gran cantidad de energía.
A esto se debe que sea difícil prender un fuego sin contar con otra fuente de calor. Pero después que comienza la combustión se produce mucho calor y esto puede llevar a que otros compuestos de carbono próximos también se prendan y así se expanda el fuego.
Cuando observamos más detenidamente esta situación, podemos ver que el propio fuego es un ejemplo muy interesante de designio. Las propiedades químicas del oxígeno y del carbono han sido establecidas de modo que ambos elementos reaccionen entre sí y produzcan la combustión sólo cuando ya hay presente una gran cantidad de calor.
Esto es algo bueno, porque de no ser así la vida en el planeta sería muy desagradable e incluso absolutamente imposible. Si el oxígeno y el carbono fuesen levemente más propensos a entrar en reacción, la combustión espontánea —autoignición— de las personas, los árboles y los animales se volvería algo común en cualquier momento en que haya un poco más de calor en el ambiente.
Por ejemplo, alguien que esté caminando por un desierto puede estallar en llamas al mediodía, momento en que el calor es más intenso. Y las plantas y los animales estarían expuestos al mismo riesgo. Y aunque la vida puede ser posible en un mundo así, ciertamente no sería muy divertida.
Por otra parte, si el carbono y el oxígeno fuesen levemente más nobles (es decir, mínimamente menos reactivos) de lo que son, sería mucho más difícil que ahora prender un fuego en el mundo: incluso podría ser imposible.
Y sin fuego no solamente seríamos incapaces de mantenernos con el calor necesario sino que hubiese sido muy probable la inexistencia de algún tipo de desarrollo tecnológico, dado que éste depende de la capacidad de trabajar con materiales como los metales: habría resultado imposible sin el calor provisto por el fuego.
Lo que muestra todo esto es que las propiedades químicas del carbono y del oxígeno han sido dispuestas del modo más apropiado a los efectos de cubrir las necesidades del género humano.
Dice Michael Denton al respecto:
»Esta curiosa no reactividad a temperaturas ambiente de los átomos de carbono y de oxígeno, combinada con las enormes cantidades de energía que caracteriza a la reacción, expresa la gran diversificación de las formas en la cumplimentación de los distintos requerimientos de la vida en la Tierra. Esta curiosa combinación no sólo facilita a las formas avanzadas de vida la inmensa energía de la oxidación de una manera controlada y ordenada, sino que también ha hecho posible el uso regulado del fuego por parte del género humano y ha permitido poner en condiciones de operar la energía masiva de la combustión para el desarrollo tecnológico«96.
En otras palabras, el carbono y el oxígeno han sido creados con propiedades que resultan ser las más aptas para la vida humana. Las propiedades de estos dos elementos nos permiten prender el fuego y hacer uso del mismo de las maneras más convenientes posibles.
Por otra parte, el mundo está lleno de fuentes de carbono (como las maderas de los árboles) aptas para la combustión. Todo esto indica que el fuego y los elementos que sirven para iniciarlo y mantenerlo, han sido creados y adaptados especialmente en función de la vida humana. En el Corán Dios habla así al género humano:
Quien os ha hecho fuego de un árbol verde del que, así, encendéis. (C. 36:80)
La utilización del oxígeno por parte del cuerpo depende mucho de las propiedades del mismo para disolverse en el agua. El oxígeno que entra a los pulmones cuando respiramos, se disuelve inmediatamente en la sangre.
La proteína llamada hemoglobulina captura esas moléculas de oxígeno y las lleva a las células del cuerpo donde, gracias al sistema enzimático especial descrito antes, se las usa para oxidar los compuestos de carbono llamados ATP, con el objeto de liberar la energía que encierran.
Todos los organismos complejos obtienen su energía de esa manera. Sin embargo, la operación del sistema depende especialmente de la solubilidad del oxígeno.
Si éste no es suficientemente soluble, a la corriente sanguínea no va a entrar la necesaria cantidad de oxígeno y las células entonces no serán capaces de generar la energía que requieren. Por otra parte, si el oxígeno fuese demasiado soluble, habría un exceso del mismo en la sangre y ello llevaría a una situación conocida como toxicidad del oxígeno.
El coeficiente de solubilidad en el agua de los distintos gases varía de uno a un millón. Es decir, el gas más soluble en agua, lo es un millón de veces más que el menos soluble también en agua.
Y es muy difícil encontrar —si es que se encuentran— gases cuyas solubilidades sean idénticas. Por ejemplo, el dióxido de carbono es unas veinte veces más soluble en el agua que el oxígeno.De todos modos, en esa vasta escala de solubilidad potencial, el oxígeno posee la necesaria para la vida humana.
¿Qué sucedería si el coeficiente de solubilidad del oxígeno en el agua fuese un poco distinto en más o en menos?
Si el oxígeno fuese menos soluble en agua (y por lo tanto en sangre) de lo que es, entraría menos a la corriente sanguínea y las células del cuerpo tendrían hambre del mismo.
Esto haría a la vida mucho más difícil para los organismos como los seres humanos, metabólicamente activos. Independientemente del esfuerzo aplicado a la respiración, nos enfrentaríamos constantemente con el peligro de vernos sofocados porque a las células del cuerpo no les llegaría el oxígeno suficiente.
Por otra parte, si la solubilidad del oxígeno en el agua fuese mayor, nos enfrentaríamos con la amenaza de la toxicidad del oxígeno mencionada antes.
El oxígeno, en realidad, es una substancia peligrosa:si un organismo absorbe muy mucho, el resultado puede ser fatal. Algo del oxígeno en la sangre entra en reacción química con el agua en la sangre.
Si la cantidad de oxígeno disuelta se vuelve demasiada elevada, las enzimas no pueden realizar su trabajo. En consecuencia, nos iríamos envenenando con cada inhalación de aire, lo que nos conduciría rápidamente a la muerte.
El químico Irwin Fridovich hace un comentario al respecto:
»Todos los organismos que respiran caen en una trampa cruel. El mismo oxígeno que los mantiene vivos les resulta tóxico y sobreviven precariamente, sólo gracias a esmerados mecanismos de defensa«97.
Lo que nos salva de esa trampa —es decir, de envenenarnos por un exceso de oxígeno o de sofocarnos por falta del mismo— es que la solubilidad del oxígeno y el complejo sistema enzimático han sido diseñados y creados con todo esmero para la función que necesitan cumplir.
Para decirlo más explícitamente, Dios no creó solamente el aire que respiramos sino también los sistemas que hacen posible que usemos ese aire en armonía perfecta.
Por supuesto, el carbono y el oxígeno no son los únicos elementos diseñados deliberadamente para que la vida sea posible. Elementos como el hidrógeno y el nitrógeno, que están presente en gran medida en los cuerpos de los seres vivientes, también poseen atributos al mismo efecto. En realidad, en la tabla periódica no se presenta ningún elemento que no cumplimente alguna función en la sustentación de la vida.
En la tabla periódica hay 92 elementos que van desde el hidrógeno (el más liviano) al uranio (el más pesado). (Ya sabemos que hay otros elementos después del uranio, pero no de modo natural, pues han sido creados bajo condiciones de laboratorio.
Ninguno de los mismos son estables). De los 92, son directamente necesarios para la vida 25, y 11 de éstos —hidrógeno, carbono, oxígeno, nitrógeno, sodio, magnesio, fósforo, azufre, cloro, potasio y calcio— constituyen aproximadamente el 99% del peso del cuerpo de cualquier ser viviente.
Los otros catorce elementos —vanadio, cromo, manganeso, hierro, cobalto, níquel, cobre, zinc, molibdeno, boro, silicio, selenio, flúor y yodo— están presentes en los organismos vivientes sólo en muy pequeñas cantidades, pero también cumplen funciones importantes fundamentales.
No se conoce muy bien la función que cumplen otros tres elementos, es decir, el arsénico, el estaño y el tungsteno. También se sabe que están presentes en la mayoría de los organismos el bromo, el estroncio y el bario, pero sus funciones son aún un misterio98.
Este amplio espectro abarca átomos de cada una de las distintas series de la tabla periódica, cuyos elementos se agrupan según los atributos de los mismos.
Esto indica que todos los grupos de elementos de la tabla periódica son necesarios para la vida, de una u otra manera. En La Química Biológica de los Elementos, J. J. R. Frausto da Silva y R. J. P.
Willams dicen lo siguiente:
»Parece que los elementos biológicos han sido seleccionados, prácticamente, de entre todos los grupos y subgrupos de la tabla periódica… lo que significa que prácticamente todos los tipos de propiedades químicas están asociados con los procesos de la vida dentro de los límites impuestos por las restricciones ambientales«99.
Incluso los elementos radioactivos pesados al final de la tabla periódica han sido formados para servicio de la vida humana. En Destino de la Naturaleza Michael Denton describe detalladamente el papel esencial que juegan esos elementos radioactivos como el uranio, en la formación de la estructura geológica de la Tierra.
La radioactividad natural está estrechamente asociada con la capacidad de retención de su calor por parte del centro de la Tierra, la cual consiste de hierro y níquel líquidos.
Este centro líquido que es la fuente del campo magnético terrestre, como vimos antes, ayuda a proteger al planeta de la radiación y partículas peligrosas del espacio, a la vez que cumple otras funciones.
Incluso los gases inertes y elementos como los metales raros —ninguno de los cuales parecieran estar involucrados en la sustentación de la vida— aparentemente están allí debido a la necesidad de asegurar que la clasificación de los elementos naturales se extienda hasta el uranio100.
En resumen, podemos decir con seguridad que todos los elementos que conocemos cumplen alguna función en la vida humana. Ninguno de ellos resulta superfluo o sin propósito. Esta situación hace más evidente Dios ha creado el universo.
Todas las propiedades físicas y químicas de los componentes del universo que hemos examinado, resultan ser exactamente lo que son con el objeto de que la vida exista.
No obstante, en este libro solamente hemos arañado la superficie de las abrumadoras evidencias de esa realidad.
Independientemente de lo que se profundice cada característica o se amplíe la investigación, esta observación general se mantiene cierta: en cada detalle del universo hay un propósito que sirve a la vida humana y cada detalle está perfectamente diseñado, equilibrado y armonizado para lograr ese propósito.
Ciertamente, esto prueba la existencia de un creador superior que hizo que este universo adquiera entidad a ese fin. Al examinar cualquier propiedad de la materia estamos contemplando el infinito conocimiento, sabiduría y poder de Dios, Quien la creó de la nada. Todas las cosas se someten a Su voluntad y es por eso que cada una y todas las cosas están en perfecta armonía entre sí.
Esta es la conclusión a la que finalmente ha llegado la ciencia del siglo XX. No obstante, se trata solamente del reconocimiento de un hecho que fue comunicado al género humano hace catorce siglos:
Dios creó todos los detalles del universo para revelar la perfección de Su propia creación:
¡Bendito sea Aquél en Cuya mano está el dominio! Es omnipotente… Es Quien ha creado siete cielos superpuestos. No ves ninguna contradicción en la creación del Compasivo. ¡Mira otra vez! ¿Adviertes alguna falla? Luego, mira otras dos veces: tu mirada volverá a ti cansada, agotada. (Corán, 67:1 y 3-4)
84. »Science Finds God«, Newsweek, 27 de julio de 1998. 
85. Robert E. D. Clark, The Universe: Plan or Accident?, London, Paternoster Press, 1961, p. 98. 
86. Fred Hoyle, Religion and the Scientists, London: SCM, 1959; M. A. Corey, The Natural History of Creation, Maryland: University Press of America, 1995, p. 341. 
87. David Burnie, Life, Eyewitess Science, London: Dorling Kindersley, 1996, p. 8. 
88. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1, Oxford: Oxford University Press, 1950, p. 490. 
89. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1, p. 490. 
90. J. B. S. Haldane, »The Origin of Life«, New Biology, 1954, vol. 16, p. 12. 
91. Michael Denton, Nature’s Destiny, pp. 115-116. 
92. Lawrence Henderson, The Fitness of the Environment, Boston: Beacon Press, 1958, pp. 247-48. 
93. L. L. Ingraham, »Enzymic Activation of Oxygen«, Comprehensive Biochemistry, (ed. M. Florkin, E. H. Stotz), Amsterdam: Elsevier, vol. 14, p. 424. 
94. La cuestión de cómo se originó el complicado sistema de enzimas que posibilita la absorción de oxígeno por parte del sistema respiratorio, es una de las cuestiones que la teoría de la evolución resulta incompetente para explicarla. Este sistema tiene una complejidad irreductible, es decir, no puede funcionar a menos que todos sus componentes lo hagan perfectamente. Por esta razón es difícil sostener que el sistema se desarrolló de formas simples a complejas, como sugiere el evolucionismo. El profesor Demirsoy, biólogo de la Universidad Hacettepe de Ankara y prominente defensor de la teoría de la evolución en Turquía, confiesa lo siguiente en la materia: »De todos modos aquí existe un gran problema. La mitocondria usa un determinado número de enzimas durante el proceso de división (con el oxígeno). La ausencia de una sola de esas enzimas detiene el funcionamiento de todo el sistema. Además no es lógico que el sistema para obtener energía del oxígeno se hubiese instituido paso a paso, pues solamente el sistema completo cumple esa función. A esto se debe que en vez de adherir como principio al desarrollo paso a paso, sentimos el impulso de abrazar la sugerencia de que todas las enzimas (enzimas Krebs) necesitaron cumplir de modo instantáneo las reacciones (que llevaron) a que la mitocondria entre en la célula, o admitir que se formaron en la célula instantáneamente. Y esto es así de simple porque los sistemas que no pueden hacer un uso completo del oxígeno —es decir, los sistemas que están en un nivel intermedio— desaparecerían tan pronto como reaccionen con el oxígeno«. (Ali Demirsoy, »Las Leyes Básicas de la Vida: Zoología General«, Volumen 1, Sección 1, Ankara, 1998, p. 578).
En tanto que la probabilidad de la generación de sólo una de las enzimas (proteínas especiales) —a lo que se refirió el profesor Demirsoy cuando dijo: »admitir que se formaron (todas) en la célula instantáneamente«— de modo repentino y casual es de 1/10950, resulta ciertamente irrazonable plantear que muchas enzimas de ese tipo se formaron por casualidad. 
95. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1, Oxford: Oxford University Press, 1959, p. 490. 
96. Michael Denton, Nature’s Destiny, pp. 122-23. 
97. Irwin Fridovich, »Oxygen Radicals, Hydrogen Peroxide and Oxygen Toxicity«, Free Radicals in Biology, (ed. W. A. Pryor), New York: Academic Press, 1976, pp. 239-40. 
98. J. J. R. Frausto Da Silva, R. J. P. Williams, The Biological Chemistry of the Elements, Oxford: Oxford Univesity Press, pp. 3-4. 
99. J. J. R. Frausto Da Silva, R. J. P. Williams, The Biological Chemistry of the Elements, Oxford: Oxford Univesity Press, p. 5. 