¿Qué es lo que hace que veamos distintos los objetos que nos rodean? ¿Qué es lo que les da distintos colores, formas, olores y sabores? ¿Por qué una substancia es dura, otra blanda y otra más fluida? Según lo leído hasta ahora podemos responder: “la diferencia entre sus átomos es lo que hace posible esas cosas”. Pero esta respuesta no es suficiente, porque si esa fuese la única causa deberían existir miles de millones de átomos con propiedades distintas. No pasa por ahí la respuesta. Muchos materiales que se ven diferentes y tienen propiedades distintas, contienen no obstante los mismos átomos. La respuesta a las preguntas anteriores hay que buscarla por el lado de la forma en que se enlazan los átomos para constituir moléculas.
En el camino de la constitución de la materia y después de la formación del átomo, el paso siguiente lo ocupan las moléculas. Se trata de las unidades más pequeñas en la determinación de las propiedades químicas de la materia. Aunque diminutas, pueden estar integradas por dos átomos o más, algunas con miles de ellos. Estos permanecen juntos dentro de las moléculas por medio de los enlaces químicos establecidos por la fuerza de atracción electromagnética. Es decir, los enlaces se forman sobre la base de las cargas eléctricas de los átomos, las que son determinadas por los electrones de su orbital más exterior. Las distintas combinaciones de las moléculas dan lugar a la diversidad de materia que vemos alrededor de nosotros. De aquí la importancia de los enlaces químicos.
Como explicamos antes, dichos enlaces se forman a través del movimiento de los electrones en el orbital más exterior de los átomos. Estos tienden a llenar ese orbital con la máxima cantidad de electrones, cediéndolos o tomándolos. El máximo posible es de ocho. Para hacer esto, el átomo recibe electrones de otro átomo para completar su “capa” más externa con ocho electrones, o si tiene en su nivel más exterior mucho menos de ocho electrones, entonces él los da a otro átomo, quedando entonces con orbitales completos. La tendencia de los átomos a intercambiar electrones suministra el ímpetu motivador básico del enlace químico que se presenta entre ellos.
Esa fuerza que los impulsa a elevar al máximo el número de electrones en su orbital más externo, hace que se formen tres tipos de enlaces: el iónico, el covalente y el metálico.
Las uniones especiales a las que se denomina “enlaces débiles”, por lo general actúan entre moléculas. Son más débiles que las existentes entre los átomos que constituyen las moléculas porque éstas necesitan estructuras más flexibles para formar la materia.
Veamos de modo resumido las propiedades de esos enlaces y cómo se forman.
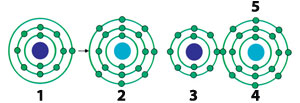
1) Atomo de sodio 2) Atomo de cloro
3) Ion de sodio
4) Ion de cloro
5) Molécula de cloruro de sodio (NaCl)
El átomo de sodio queda con carga positiva al ceder su electrón más externo a un átomo de cloro, convirtiéndose éste en negativo debido al electrón que recibió. Ambos forman un enlace iónico por medio de ambas cargas opuestas que se atraen entre sí. 24
Los átomos que se combinan por medio de enlaces iónicos, intercambian electrones para completar ocho en sus orbitales más externos. El que tiene hasta cuatro electrones en su “capa” más externa, los pasa al que tiene más de cuatro electrones también en el orbital más externo y que es con el que se va a combinar, es decir, con el que se va a enlazar. Las moléculas formadas por este tipo de enlace poseen estructuras cristalinas (tridimensionales). La sal de mesa común (NaCl) se cuenta entre las sustancias así formadas. ¿Por qué los átomos tienen esa tendencia? ¿Qué sucedería si no la tuviesen?
Hasta la actualidad sólo se puede definir en términos generales el porqué de los enlaces formados por los átomos. Aún no se comprende a qué se debe que los átomos adhieran a dicho principio. ¿Será posible que los átomos decidan por sí mismos que en su orbital más externo deben tener ocho electrones? Definidamente no. Se trata de un comportamiento tan decisivo que evidentemente se ubica más allá del átomo porque éste no tiene intelecto, voluntad o conciencia. Esa cantidad de ocho es la clave en la combinación de los átomos para constituir moléculas, es decir, el paso siguiente en la creación de la materia y, en consecuencia, del universo íntegro. Si los átomos no tuviesen esa tendencia basada en el principio mencionado, no existirían las moléculas y por ende tampoco la materia. Pero desde el momento en que fueron creados y gracias a dicha inclinación, los átomos han estado sirviendo en la formación de las moléculas y de la materia de una manera perfecta.
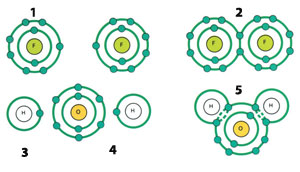
1)Atomo de flúor
2)Molécula de flúor (F2) (F2)
3)Atomo de hidrógeno
4)Atomo de oxígeno
5)Molécula de agua (H2O)2O
Algunos átomos forman nuevas moléculas por medio de enlaces covalentes, compartiendo los electrones de sus orbitales más externos 25.
Los científicos que estudiaron los enlaces entre los átomos enfrentaron una situación interesante. Mientras algunos de éstos cedían o tomaban electrones para enlazarse, algunos compartían los de sus orbitales más externos. Una investigación más avanzada reveló que muchas moléculas decisivas para la vida deben su existencia a esos enlaces denominados covalentes.
Veamos un ejemplo simple para entenderlo mejor. Como ya mencionamos, los átomos pueden tener un máximo de dos electrones en su orbital más cercano al núcleo. El átomo de hidrógeno tiene un solo electrón con la tendencia a tener dos para convertirse en estable. En consecuencia el átomo de hidrógeno constituye un enlace covalente con otro átomo de hidrógeno. Es decir, los dos átomos de hidrógeno comparten el electrón solitario como un segundo electrón. Así se forma la molécula H2.
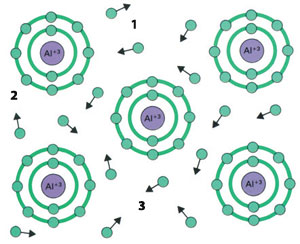
1)Enlace metálico
2)Electrón
3) Ion de aluminio
Los enlaces entre los átomos de metales son muy distintos de otras formas de enlaces químicos. Cada átomo de metal contribuye con sus electrones más externos a un conjunto común. Ese “mar de electrones” explica una propiedad clave de los metales: la capacidad de conducir electricidad. 26
Si un gran número de átomos se acercan por medio de compartir electrones, a eso se lo denomina “enlace metálico”. Metales como el hierro, el cobre, el zinc, el aluminio, etc., que forman la materia prima de muchas herramientas e instrumentos que vemos o usamos diariamente, han adquirido un cuerpo tangible y substancial como resultado de ese tipo de enlace que forman los átomos que los constituyen.
Los científicos no pueden responder porqué los electrones de esos átomos tienen dicha propensión. Lo que resulta más interesante es que los organismos vivos deben su existencia a esa tendencia.
¿Desea saber cuántas combinaciones pueden formar estos enlaces? En los laboratorios se producen nuevos compuestos todos los días. En la actualidad es posible hablar de unos dos millones de ellos. El compuesto químico más simple puede ser tan pequeño como la molécula de hidrógeno, pero también hay otros integrados por millones de átomos 27.
¿Cuántos compuestos diferentes puede formar como máximo un elemento? La respuesta a esta pregunta es realmente interesante, porque, por una parte, hay algunos que no interactúan con otros (gases inertes), mientras que, por otra parte, tenemos el átomo de carbono que puede formar hasta 1.700.000 compuestos. Como dijimos arriba, la cantidad total de compuestos es de unos 2.000.000. 108 elementos de un total de 109, forman 300.000 compuestos. Pero el carbono solo forma, sorprendentemente, 1.700.000 compuestos.
El carbono es el elemento más esencial para los seres vivientes porque todos ellos están integrados por compuestos de carbono. Harían falta muchísimas páginas para describir las propiedades del átomo de carbono, extremadamente importante para nuestra existencia, aunque la ciencia de la química aún no ha podido descubrir todos sus atributos. Aquí mencionaremos solamente algunos de los más significativos.

1) Atmósfera 2)Hidrosfera 3)Litosfera 4)H 0.9% 5)MG 1.9% 6)Ca 3.4% 7) Ti 0.5%
8)Na 2.6% 9)K 2.4% 10) Fe 4.7% 11) O 49.5% 12) Si 25.8% 13 )Al 7.6%
Las Materias Primas del Universo y la Tabla Periódica: En la naturaleza se encuentran en estado libre noventa y dos elementos, en tanto que otros diecisiete se constituyen artificialmente en laboratorios o en reacciones nucleares. Se los ordena en una tabla según la cantidad de sus protones y se la llama “Tabla Periódica”. Aprimera vista la misma puede parecer un montón de casilleros que contienen letras y números en los ángulos. Pero en esta Tabla se ubican los elementos de todo el universo, incluidos los del aire que respiramos y los que contienen nuestros cuerpos.
Estructuras tan diversas como la membrana celular, los cuernos del alce, el tronco del pino, la lente del ojo y el veneno de la araña, se forman de compuestos de carbono. Combinado con el hidrógeno, el oxígeno y el nitrógeno en muy distintas cantidades y disposiciones geométricas, se presenta en una inmensa variedad de materiales con aptitudes muy distintas. ¿De dónde obtiene el carbono la capacidad para formar alrededor de 1.700.000 compuestos?
Una de sus cualidades más extraordinarias es la de formar cadenas con gran facilidad alineándose uno a continuación del otro. La cadena de carbono más corta está integrada por dos átomos de carbono. Aunque no se dispone de una cifra exacta de cuántos son los que integran la cadena más larga, podemos hablar de una con alrededor de 70 enlaces. La posición excepcional del carbono se puede comprender si consideramos que fuera de éste, el elemento que forma una cadena más larga es el silicio con 6 enlaces 28.
La razón por la que el carbono posee esa capacidad de formar cadenas con tantos enlaces estriba en no son exclusivamente lineales. Pueden ser ramificadas o constituir polígonos. Y la forma que adopte es muy importante.
Atomo de carbono
Por ejemplo, si en dos compuestos de carbono los átomos se combinan de manera diferente, se forman dos sustancias disímiles, lo cual es decisivo para la vida.
Algunas moléculas de compuestos de carbono consisten en unos pocos átomos. Otras contienen miles o incluso millones. Ningún otro elemento es tan versátil como el carbono para formar moléculas muy durables y estables. Dice David Burnie en su libro La Vida:
El carbono es un elemento poco común. Sin su presencia y sus propiedades extraordinarias, lo más probable es que no hubiese existido la vida sobre la Tierra 29.
Respecto a la importancia del carbono para los seres vivientes, escribe el químico británico Nevil Sidgwick en Los Elementos Químicos y Sus Compuestos:
El carbono es único entre los elementos por la cantidad y variedad de compuestos que puede formar. Ya han sido aislados y descritos más de 250.000, pero aún tenemos una idea muy imperfecta de sus atributos, puesto que es el fundamento de todas las formas de la materia viviente 30.
La clase de compuestos constituidos exclusivamente de carbono e hidrógeno se llama “hidrocarburos”. Configura una gran familia que incluye el gas natural, el petróleo, el kerosene y los aceites lubricantes. Los hidrocarburos etileno y propileno conforman la base de la industria petroquímica. Hidrocarburos como el benceno, el tolueno y la trementina son familiares para quienes trabajan con pinturas. La naftalina que protege nuestras ropas de las polillas también es un hidrocarburo. Combinado con cloro o flúor da lugar a anestésicos, a productos usados en los extintores de fuego y a los freones que se emplean en refrigeración.
TRES MOLECULAS SIMILARES RESULTAN TRES SUBSTANCIAS DISTINTAS
La diferencia de aunque más no fuese unos pocos átomos entre las moléculas, conduce a resultados muy distintos. Por ejemplo, observe con atención los constituyentes de las dos moléculas que se representan abajo. Se las ve muy similares, con una diferencia muy pequeña en sus componentes carbono e hidrógeno. La resultante es dos substancias totalmente opuestas:
C18H24O2 ve C19H28O2
¿Puede adivinar de qué son estas moléculas? Se lo diremos. La primera es de estrógeno y la segunda de testosterona. Es decir, la primera es la hormona responsable de las características femeninas y la otra la de las características masculinas. Lo interesantísimo es que la diferencia de unos pocos átomos puede causar diferencias sexuales. Ahora observemos la fórmula que sigue
C6H12O2
No se parece mucho esta molécula a las del estrógeno y la testosterona? ¿Es otra hormona? Se lo decimos: es la molécula de glucosa. En base a lo ejemplos dados aquí queda muy en claro que la diferencia en la cantidad de átomos puede producir sustancias muy distintas. Por una parte tenemos las hormonas responsables de las características sexuales y por otra parte nos encontramos con la glucosa, un alimento básico.
¿Qué Sucedería si Cada Atomo Cercano a Otro Reaccionase de Inmediato?
 |
|---|
Ni el agua se forma por sólo juntar moléculas de oxigeno y de hidrógeno, ni el hierro se oxida apenas entra en contacto con el aire. De ser las cosas así, nuestro planeta no sería como lo conocemos. Para que se constituya el agua o para que el hierro se oxide, hace falta cumplimentar alguna condición, como lo es la energía requerida en cada caso, a la que se llama “energía de activación”. Si el simple contacto de un elemento con otro produjera reacciones de inmediato, sería imposible hasta sentarse en una silla porque los átomos que la forman se combinarían instantáneamente con los átomos de quien allí se sentara y el conjunto se convertiría en una existencia entre silla y ser humano (!). En un mundo así no se podría hablar de “vida”, como la conocemos nosotros o directamente no existiría. Esto indica que cada proceso que dio y da origen a cada elemento o materia se ajusta a condiciones precisas, no se da de cualquier manera, pues de otro modo se destruirían los equilibrios existentes. Lo antedicho señala claramente que la inclinación del eje, la masa, la extensión de la superficie y la proporción de gases en la atmósfera de nuestro planeta, así como la distancia a la Luna, al sol y muchos otros factores, son exactamente los que corresponden para que la vida se mantenga. Además, eso mismo está indicando que el conjunto de lo que acaece, en la proporción y medida del caso, no pudo formarse progresivamente, casualmente o a través de la prueba y error, sino que fue dispuesto por Dios, el Dueño del poder Supremo, Quien determina la característica de lo viviente en particular y del cosmos en general. El papel de la ciencia en todo esto es dar a conocer las leyes físicas que se observan. Como explicamos al comienzo, frente a tales fenómenos pierden sentido interrogantes del tipo “¿cómo?”, “¿para qué?”, “¿de qué modo?”. Por medio de esas preguntas lo más que logramos son las particularidades de las leyes existentes. Las preguntas esenciales deberían ser “¿por qué?” y “¿quién es el creador de esas leyes?”, lo que sigue siendo un enigma, algo imposible de contestar, para los científicos que adhieren ciegamente a sus dogmas materialistas. En este punto, donde los materialistas se estancan o quedan absortos, las cosas resultan muy claras para los que razonan adecuadamente. El equilibrio perfecto en el universo, que no se puede explicar como producto de las casualidades, ha sido originado por la orden de una mente y voluntad soberanas, según lo comunica un versículo coránico:
...Dios tiene todo en cuenta (Corán, 4:86).
El hace todo con un equilibrio, orden y cálculo muy precisos
Como dijo el químico Sidgwick, la mente humana no llega a comprender toda la potencialidad de este átomo que sólo tiene seis protones, seis electrones y seis neutrones. Es imposible que se dé por casualidad, aunque más no fuese, una sola de las propiedades de este átomo esencial para la vida.
Dios creó y abarca el átomo de carbono y todo lo demás, de manera perfectamente apropiada, en beneficio de los seres vivientes.
De Dios es lo que está en los cielos y en la tierra. Dios todo lo abarca (Corán, 4:126).
Los enlaces que combinan los átomos en las moléculas son mucho más fuertes que los enlaces intermoleculares. Estos últimos pueden ayudar a la formación de millones e incluso de miles de millones de vinculaciones distintas.
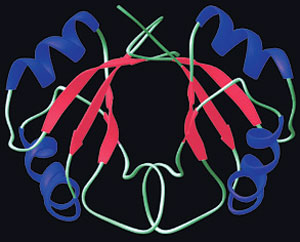
Las proteínas tienen una configuración tridimensional especial para cumplir sus papeles decisivos en nuestro cuerpos. Los enlaces débiles entre las moléculas forman dichas estructuras.
Pero, ¿cómo se combinan las moléculas para formar la materia?
Puesto que las moléculas se vuelven estables después de formarse, ya no intercambian átomos.
Entonces, ¿qué las mantiene juntas?
En un esfuerzo por responder a esta pregunta se vertieron diversas teorías. Las investigaciones demostraron que las distintas combinaciones de moléculas dependen de las propiedades de los átomos que las componen.
Los enlaces que se producen son muy importantes para la química orgánica, es decir, la química de los seres vivientes, porque las moléculas más importantes que constituyen la vida se forman debido a su capacidad para dar lugar a ese tipo de vinculaciones de las que hablamos. Tomemos el caso de las proteínas. Las formas complejas tridimensionales de las proteínas, que son los “ladrillos” de lo viviente, se forman gracias a esos enlaces. Esto significa que para la configuración de la vida el enlace químico débil entre moléculas es al menos tan necesario como los enlaces químicos fuertes entre los átomos. Por cierto, la intensidad de los mismos posee un determinado valor.
Continuemos con el ejemplo de la proteína. Moléculas llamadas aminoácidos se combinan para formar proteínas, resultando éstas mucho más grandes que sus componentes. Los átomos que integran las proteínas se vinculan por medio de enlaces covalentes, en tanto que los aminoácidos de la proteína se reúnen por medio de enlaces débiles para producir modelos tridimensionales. Las proteínas pueden funcionar en los organismos vivos, solamente si tienen estas estructuras tridimensionales. Si esos enlaces no existiesen tampoco existirían las proteínas y en consecuencia la vida.
El “enlace de hidrógeno”, que es del tipo débil, juega un gran papel en la formación de sustancias muy importantes para la vida. Por ejemplo, las moléculas que componen el agua --la base de la vida-- se combinan por medio de enlaces de hidrógeno.
Un líquido específicamente elegido para la vida --el “agua”-- cubre dos terceras partes de la superficie de nuestro planeta. Los cuerpos de todo lo viviente en la Tierra cuentan con este líquido muy especial en una proporción que va del 55% al 95% del volumen total de los mismos. La vida está presente en cualquier lugar que haya agua, independientemente de la temperatura. Es así que encontramos bacterias en los manantiales con temperaturas cercanas al punto de ebullición y algunos musgos en los glaciares en fundición. Incluso en una gota de agua que cuelga de una hoja después de llover, aparecen, se reproducen y mueren miles de organismos microscópicos.

"¿No ves cómo hace Alá bajar agua del cielo y la tierra verdea? Alá es sutil, está bien informado."(corán,22:63)
¿Cómo se vería la Tierra si no hubiese agua? El desierto lo invadiría todo. En lugar de los mares habría abismos y fosos estremecedores. El cielo se vería despejado y con un color extraño.
Pero el agua no es algo que se forma fácilmente. Supongamos en primer lugar que en una probeta ponemos moléculas de hidrógeno y de oxígeno --los compuestos del agua-- y los dejamos allí durante muchísimo tiempo. El agua no aparecerá aunque permanezcan juntos durante cientos de años. Y si se presenta, será en una cantidad muy pequeña en el fondo del recipiente, posiblemente después de miles de años.
La razón por la que el agua se forma tan lentamente bajo dichas circunstancias reside en la temperatura. El oxigeno y el hidrógeno reaccionan de un modo muy parsimonioso a temperatura ambiente. Cuando ambos elementos se presentan libres, se los encuentra como moléculas de H2 y O2. Para constituir la molécula de agua deben colisionar, a consecuencia de lo cual debilitan los enlaces que los unen como moléculas, lo que permite que se combinen los átomos de hidrógeno y oxígeno. El aumento de la temperatura eleva la energía y por lo tanto la velocidad de las moléculas, lo que lleva a un aumento del número de choques entre ellas. Así se acelera la reacción. Sin embargo, normalmente no existe en el planeta la temperatura suficientemente elevada para formar agua. El calor que se requiere al efecto estuvo presente durante la formación de la Tierra. Fue entonces cuando se originó el agua en la cantidad que tenemos hoy día.
Después de eso se produce el proceso de evaporación, condensación en la atmósfera y precipitación como lluvia o hielo, pero no hay un aumento de la cantidad de la misma sino un ciclo perpetuo de cambio de estado.
El agua posee muchas propiedades químicas excepcionales. Cada molécula de agua se forma por la combinación de átomos de hidrógeno y de oxígeno. Es realmente interesante que estos dos gases, uno reactivo y el otro inflamable, se combinen para formar un líquido, o mejor dicho, el agua.
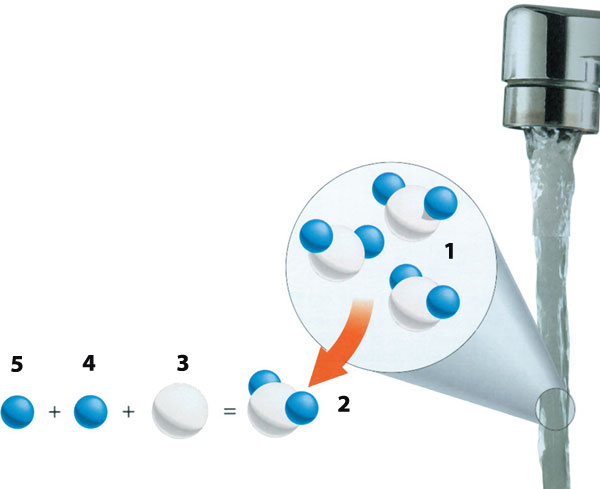
1) Molécula de agua 2) H2O 3) Oxígeno 4) Hidrógeno 5) Hidrógeno
Veamos ahora de manera resumida cómo se da ese proceso químico. La carga eléctrica del agua es cero, es decir, es neutra. No obstante, debido al tamaño de los átomos de hidrógeno y de oxígeno, este último en la molécula de agua posee una carga levemente negativa, en tanto que el primero cuenta con una carga levemente positiva. Al juntarse dos o más moléculas de agua, esas cargas negativas y positivas se atraen mutuamente para formar un enlace especial llamado “enlace de hidrógeno”, el cual es muy débil y de una vida incomprensiblemente corta. La duración de un enlace de hidrógeno es aproximadamente de una mil millonésima de segundo. Pero apenas se rompe uno se forma otro. Que las moléculas de agua se adhieran entre sí apretadamente y retengan su forma líquida, se debe a que es un enlace débil el que las cohesiona.

Si el agua no hubiese tenido la propiedad de congelarse desde la superficie hacia el fondo, una gran parte de los mares estarían congelados en el lapso de un año y la vida marítima estaría en peligro..
Los enlaces de hidrógeno también permiten que el agua resista los cambios de temperatura. Aunque la gradación térmica del aire aumente repentinamente, la del agua lo hace lentamente. Y si la temperatura del aire desciende bruscamente, la del agua, por el contrario, lo hace suavemente. Son precisos amplios cambios de temperatura ambiente para provocar una modificación considerable de la temperatura del agua. La energía térmica de ésta, significativamente elevada, importa grandes beneficios para la vida. Recurriendo a un ejemplo simple, consideremos la gran cantidad de agua que hay en nuestros cuerpos. Si el agua sufriese las vicisitudes de la temperatura ambiente con la misma velocidad, nos veríamos afiebrados o congelados de modo repentino.
Gracias a esa diferencia es que el agua necesita una elevada energía térmica para evaporarse. En consecuencia, al producirse la evaporación la temperatura disminuye. Por ejemplo, la temperatura normal del cuerpo humano es de 36°C y puede llegar a tolerar hasta 42°C. El intervalo entre ambos valores es muy pequeño y puede cubrirse con sólo trabajar bajo el sol durante unas cuantas horas. Pero el cuerpo gasta una gran cantidad de energía térmica al sudar, es decir, sacando al exterior el agua que poseemos en el cuerpo. Y eso reduce la temperatura. Si no contásemos con ese mecanismo automático, podría ser fatal realizar la actividad antes indicada.
Los enlaces de hidrógeno facilitan al agua otra propiedad extraordinaria: resulta más viscosa en estado líquido que en estado sólido. La mayoría de las substancias son más viscosas en estado sólido. Sin embargo, el agua se expande mientras se congela. Eso se debe a que los enlaces de hidrógeno evitan que las moléculas de agua se vinculen entre sí de un modo demasiado apretado y entonces queda mucho espacio entre ellas. Los enlaces de hidrógeno se descomponen con el agua en estado líquido, lo cual hace que los átomos de oxígeno se junten más entre sí y den lugar a una estructura más viscosa. En consecuencia el hielo, por el contrario, resulta más liviano.
Por lo común, si se funde algún metal y dentro de lo fundido se arrojan pedazos sólidos del mismo, van a parar al fondo del recipiente de inmediato. Pero en el caso del agua y del hielo la cosa es distinta. Los icebergs que pesan decenas de miles de toneladas flotan en el agua como corchos. ¿Qué beneficio nos puede proveer esta propiedad del agua?
Respondamos a la pregunta con el ejemplo de un río. Cuando hace mucho frío no se congela todo el afluente sino solamente la superficie. El agua alcanza su estado más pesado a los 4°C. Al llegar a esa temperatura se precipita al fondo. El hielo se forma en la superficie como una capa y debajo de la misma el agua sigue fluyendo. Puesto que a 4°C distintos organismos permanecen vivos, allí continúa la existencia.
Esta propiedad singular que Dios le ha dado al agua hace posible la vida en la Tierra. El Todopoderoso nos comunica en el Corán la importancia de esta gran bendición brindada al ser humano:
El es Quien ha hecho bajar para vosotros agua del cielo. De ella bebéis y de ella viven las matas (los vegetales) con que apacentáis. Gracias a ella, hace crecer para vosotros los cereales, los olivos, las palmeras, las vides y toda clase de frutos. Ciertamente, hay en ello un signo para gente que razona (Corán, 16:10-11).
Sabemos que el agua hierve a 100°C y se congela a 0°C. En realidad, bajo circunstancias normales, debería hervir a los 180°C. ¿Por qué?

Debido a que la densidad del agua congelada es menor que la del agua líquida, el hielo flota sobre esta última.
En la tabla periódica, las propiedades de los elementos en el mismo grupo varían de modo progresivo desde los livianos a los pesados. Este orden es más evidente en los compuestos de hidrógeno. Los que comparten el mismo grupo con el oxígeno en la tabla periódica se llaman “hidruros”. El agua en realidad es “hidruro de oxígeno”. Los hidruros de otros elementos en este grupo tienen la misma estructura molecular que la molécula de agua.
El punto de ebullición de estos compuestos varía de forma progresiva desde el sulfuro a los más pesados. Sin embargo, el punto de ebullición del agua, inesperadamente, marcha a contramano de ese modelo. El agua (hidruro de oxígeno) hierve a 80°C menos que lo que es de esperar. Otra situación sorprendente tiene que ver con su punto de congelamiento. Nuevamente, según el orden en el sistema periódico, es de suponer que el agua se congele a –100°C. Pero esta suposición no se cumple y se congela a 0°C, es decir, 100°C por encima de lo que lo debería hacer. Esto nos lleva a preguntarnos porqué entre los hidruros sólo el agua desobedece las reglas del sistema periódico.
Las leyes de la física, de la química y, en general, todo lo que denominamos “normas”, son intentos por explicar el equilibrio extraordinario y las particularidades de la creación que existen en el universo. Todas las investigaciones llevadas a cabo en el siglo XX muestran más que nunca que el conjunto de armonías físicas en el universo están hechas a la medida para la vida humana. Los estudios revelan que todas las leyes de la física, la química y la biología actuales, como así también la atmósfera, el sol, los átomos, las moléculas, etc., tienen un orden determinado que es el necesario para sustentar la vida humana. El agua es apropiada para la vida hasta tal punto, que no tiene comparación con ningún otro líquido. Además, la mayor parte de la superficie del planeta está cubierta con agua en la cantidad requerida para que la vida exista. Es obvio que todas estas cosas no pueden ser producto de casualidades, sino que en el universo hay un orden perfecto y un diseño que todo lo abarca.

Las moléculas en la superficie de un líquido experimentan una fuerza de empuje hacia el interior. Se trata de la tensión superficial, la cual provee una fuerza de cohesión a las moléculas de ese área lo suficientemente importante como para que no se hundan las patas de un insecto. La elevada tensión superficial del agua es esencial en los procesos fisiológicos. 31
Las propiedades físicas y químicas del agua que dejan con la boca abierta a cualquiera, revelan que este líquido ha sido creado específicamente para la vida humana. Dios da vida a los pueblos a través del agua y es mediante ella que hace surgir todo lo que necesitan los humanos para mantener su existencia. Por medio del Corán Dios convoca a la gente a meditar acerco de esto:
Y El es Quien ha hecho bajar agua del cielo. Mediante ella hemos sacado toda clase de plantas y follaje, del que sacamos granos arracimados. Y de las vainas de la palmera, racimos de dátiles al alcance. Y (hemos hecho crecer) huertos plantados de vides, y los olivos y los granados, parecidos y diferentes. Cuando fructifican, ¡mirad el fruto que dan y cómo madura! Ciertamente, hay en ello signos para gente que cree (Corán, 6:99).
El aire que respiramos, es decir, la atmósfera más baja, está compuesto principalmente de oxígeno gaseoso, es decir, O2. Ello significa que cada una de las moléculas de oxígeno en la atmósfera más baja contiene dos átomos. Pero a veces puede contener tres (O3). En ese caso ya no se llama oxígeno sino “ozono” y se trata de un gas completamente distinto al O2.
Dios es Quien ha creado los cielos y la tierra y ha hecho bajar agua del cielo, mediante la cual ha sacado frutos para sustentaros. Ha sujetado a vuestro servicio las naves para que, por Su orden, surquen el mar. Ha sujetado a vuestro servicio los ríos. Ha sujetado a vuestro servicio el sol y la luna, que siguen su curso. Ha sujetado a vuestro servicio la noche y el día. Os ha dado de todo lo que Le habéis pedido. Si os pusierais a contar las gracias de Dios, no podríais enumerarlas. El hombre es, ciertamente, muy impío, muy desagradecido (Corán, 14:32-34)
Es preciso sopesar algo. En tanto que la molécula de oxígeno se forma cuando se combinan dos átomos de oxígeno, ¿por qué se forma un gas distinto cuando se combinan tres átomos de oxígeno? Si en una molécula se combinan dos o tres átomos de oxígeno iguales, ¿por qué se producen dos gases distintos? Antes de responder a estas preguntas será mejor que veamos qué es lo que diferencia a uno del otro.

¿De qué modo el cloro destruye el ozono?
¿De qué modo el cloro destruye el ozono? El cloro reacciona con el ozono produciendo una molécula de oxígeno y un ion de hipoclorito (OCI-) (1). El ion reacciona con un átomo de oxígeno para (2) liberar cloro, el cual (3) reacciona con otra molécula de ozono a la que destruye 32.
El oxígeno O2 se encuentra en la atmósfera más baja y permite la existencia de todo lo vivo a través de la respiración. El ozono O3 es un gas venenoso con un olor muy feo y se encuentra en los estratos más elevados de la atmósfera. Si tuviésemos que respirar ozono en vez de oxígeno, moriríamos todos.
El ozono está en la atmósfera superior porque allí cumple una función esencial para la vida. Constituye un estrato de aproximadamente veinte kilómetros de espesor y rodea a la Tierra como un cinturón. Absorbe los rayos ultravioletas emitidos por el sol, con lo que evita que lleguen a la superficie terrestre en su totalidad. Puesto que dichos rayos poseen una energía muy elevada, consumirían por incineración los compuestos o elementos con los que entra en contacto directo y la vida no se formaría. Es decir, la capa de ozono resulta un escudo protector.
La supervivencia en la Tierra exige la práctica de la respiración y la protección frente a los rayos dañinos provenientes del sol. Quien permite que ese sistema se constituya es Dios, gobernante de cada átomo, de cada molécula. Sin el permiso de Dios, ninguna fuerza, cualquiera que sea, podría juntar esos átomos en distintas proporciones de modo que pasen a ser moléculas de ozono o de oxígeno.
Los sentidos gustativo y olfativo nos proveen de percepciones que hacen más agradable nuestra existencia. El placer derivado de dichos sentidos ha sido materia de interés desde la antigüedad y sólo recientemente se descubrió que se deben a interacciones moleculares.

PIPERINA
Es el componente activo de la pimienta blanca y negra (las bayas de la enredadera tropical Piper nigrum). La pimienta negra se obtiene dejando fermentar el fruto verde y secándolo después. La pimienta blanca se obtiene quitando la piel y la pulpa de las bayas maduras, dejando secar las semillas 33
“Gusto” y “olor” son sólo percepciones creadas por distintas moléculas en nuestros órganos sensoriales. Por ejemplo, los olores de comidas, bebidas, frutas y flores, consisten en moléculas volátiles. ¿Cómo sucede eso?

Para-HIDROXIFENIL-2-BUTANONAy IONONA
La mezcla de estas dos moléculas produce un aroma muy agradable. La butanona es la principal molécula responsable del olor de las frambuesas maduras. El olor del fruto recién cosechado se debe parcialmente a la ionona, la cual también es responsable del aroma de las violetas y el heno secado al sol. La ionona es el componente de la fragancia del aceite de violetas. 34
Esas moléculas, como las del aroma de la vainilla o de la rosa, llegan a receptores ubicados en los pelillos vibratorios de la región nasal, llamada epitelio. La interacción de las moléculas con los pelillos es percibida en el cerebro como “olor”. Hasta ahora se identificaron siete tipos de receptores en la cavidad nasal, los cuales están ubicados en una membrana olfativa de 2-3 cm2. Cada uno de esos receptores corresponde a un olor básico. De la misma manera, hay cuatro tipos distintos de receptores químicos en la parte de adelante de nuestra lengua. Corresponden a los gustos salado, dulce, amargo y ácido. El cerebro percibe como señales químicas las moléculas que llegan a los receptores de nuestros órganos sensoriales.

FURILMETANETIOL
Esta molécula es una de las responsables del aroma del café, cuya acción estimulante se debe a la cafeína. El color de su grano tostado (ver a la izquierda) se debe en gran medida a la reacción que ocurre cuando las substancias orgánicas con contenido de nitrógeno son calentadas. Adentro de las semillas se encuentran por un tiempo las moléculas responsables del gusto y la acción estimulante. 35
Se ha descubierto cómo son percibidos y cómo se forman el olor y el gusto, aunque hasta ahora los científicos no se pusieron de acuerdo en porqué ciertas sustancias tiene un olor más fuerte que el de otras y porqué algunos gustos resultan agradables y otros no.
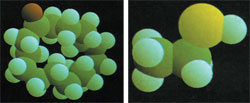
La representación de arriba pertenece a una molécula maloliente. La de la izquierda a una molécula aromática. Como podemos apreciar en estas representaciones, lo que distingue el mal olor del olor agradable es la pequeña diferencia que existe en un microcosmo invisible a simple vista.
Meditemos un minuto. Podríamos vivir en un mundo sin olores y sin sabores. Puesto que no tendríamos ni idea de dichos conceptos, no se nos ocurriría poseer esas percepciones. Sin embargo, no es eso lo que sucede. De un suelo marrón o pardo con un olor característico, salen cientos de tipos de frutas deliciosas con distintos aromas, plantas y flores con cientos de colores, formas y fragancias. ¿Por qué esos átomos que por un lado se juntan de una manera extraordinaria para dar lugar a la materia, por otra parte se combinan para producir gustos y olores? Si bien a todos los productos de la tierra con sus variadas características los consideramos algo normal, en realidad son una gracia concedida y parte del arte de un Creador magnífico que hacen más grato nuestro paso por el planeta.
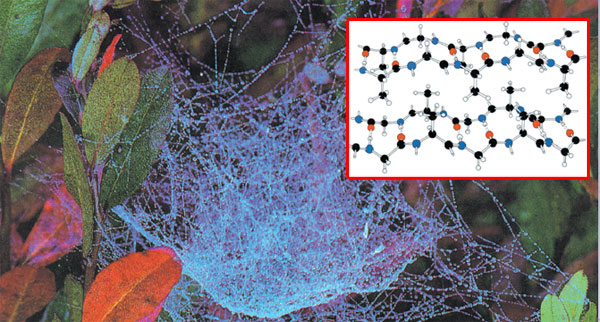
b-QUERATINA
La seda, el nombre común de la b- Queratina, es el fluido solidificado excretado por una serie de insectos y arañas. El más valioso es el del gusano de seda, la oruga de la mariposa nocturna llamada seda. Ese fluido es un polipéptido constituido en gran medida de glicina, alanina y cantidades más pequeñas de otros aminoácidos. Las moléculas de b-Queratina no forman una hélice. Forman láminas --que luego se apilan-- de aminoácidos en donde la glicina se presenta en una de las caras. Esa estructura plana se percibe al tocar la seda. 36
En cuanto a otros seres vivientes, algunos sólo comen pasto y otros distintas sustancias alimenticias. Muchos de esos alimentos no tienen buen olor o un gusto exquisito. Y aunque los posean, no significan gran cosa para las existencias que carecen de conciencia como la que tenemos los humanos. También nosotros podríamos alimentarnos de un solo tipo de nutriente como otras criaturas. ¿Han pensado cómo sería la vida si habría que comer un único tipo de alimento y beber sólo agua? Por lo tanto, el sabor y el olor, como todas las otras bendiciones, son atributos preciosos que nos brinda Dios, el poseedor de la gracia y los dones infinitos. La ausencia de uno sólo de esos sentidos, haría realmente triste nuestra existencia. El ser humano debería actuar siempre en conformidad con las normas establecidas por Dios para demostrarle así nuestro agradecimiento por todos los favores que nos concede. En compensación por esa actitud, El nos promete una vida eterna provista de bendiciones sin límite, muy superiores a las que llegamos a conocer en la Tierra. Las de aquí sirven de “muestra gratis” respecto de las que tendremos en el más allá. Pero lo que se recibirá debido a una vida llena de ingratitud, desatención y negligencia para con El, no será más que lo que con justicia nos mereceremos:
Y cuando vuestro Señor anunció: “Si sois agradecidos, os daré más (de Mi gracia). Pero, si sois desagradecidos,... Ciertamente, Mi castigo es severo” (Corán, 14:7).
Lo que hemos dicho hasta ahora revela que lo que llamamos materia no es una entidad con un color, olor, sabor o forma específico como creíamos. Imaginamos que “materia” es nuestro cuerpo, la sala de estar, nuestra casa, es decir, el mundo, el universo. Pero en realidad todo ello es energía. Entonces, ¿por qué podemos ver y tocar lo que nos rodea?
El motivo por el que percibimos a esas cosas como materia es el choque de los fotones con los electrones en los orbitales de los átomos y la atracción y repulsión de los átomos entre sí.
Usted no está tocando el libro que ahora cree que tiene en sus manos... En realidad, los átomos de sus manos repelen a los átomos del libro y la sensación de “tocar” depende de la intensidad de dicha repulsión. Como mencionamos al hablar de la estructura de los átomos, éstos pueden acercarse entre sí como máximo una distancia igual al diámetro de los mismos. Además, los únicos que pueden llegar a acercarse tanto son los que reaccionan entre sí. Por lo tanto, cuando ni siquiera los átomos de la misma sustancia pueden entrar en contacto, es más que imposible que nosotros toquemos, apretemos o levantemos con nuestras manos una sustancia distinta de nosotros. Si pudiésemos acercarnos tanto al objeto en nuestras manos, formaríamos parte de una reacción química con el mismo, lo que haría imposible que nosotros o cualquier otro ser viviente en nuestro lugar sobreviva ni un segundo, a la vez que nos transformaríamos en otra cosa.
El cuadro final que emerge de esta situación es extremadamente interesante: vivimos en un mundo compuesto en un 99,95% de un espacio lleno de átomos que consisten casi totalmente en energía . En realidad nunca tocamos lo que creemos que “tocamos o sostenemos”. Entonces, ¿en qué grado percibimos la materia que vemos, oímos u olemos? O mejor dicho, ¿vemos, oímos u olemos realmente dichas sustancias? Para nada. Nos habíamos ocupado de esto cuando hablamos del 37os electrones y de las moléculas. Recuerden que es literalmente imposible que podamos ver la materia que creemos que existe, porque el fenómeno al que denominamos “visión” abarca ciertas imágenes que se forman en nuestro cerebro por medio de los fotones provenientes del sol o de otra fuente de luz que golpean la materia. Esta absorbe parte de esa luz y emite o refleja el resto, que es lo que llega a nuestros ojos. En consecuencia, ¿cuántos de los datos referidos a la materia se nos comunican por medio de dicha información? No poseemos ninguna prueba de que las formas originales de la materia que existe en el exterior sean reflejadas a nosotros completamente.
27. L. Vlasov, D. Trifonov, 107 Stories About Chemistry, 1977, p. 117.
28. L. Vlasov, D. Trifonov, 107 Stories About Chemistry, 1977, p. 118.
29. David Burnie, Life, Eyewitness Science, London: Dorling Kindersley, 1996, p. 8.
30. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol. 1, Oxford University Press, 1950, p. 490.
31. Martin Sherwood and Christine Sulton, The Physical World, Oxford University Press, 1988, p. 30.
32. Structure of Matter, The Time Inc. Book Company, 1992, p. 76.
33. P. W. Atkins, Molecules, Scientific American Library, p. 115.
34. P. W. Atkins, Molecules, Scientific American Library, p. 128.
35. P. W. Atkins, Molecules, Scientific American Library, p. 130.
36. P. W. Atkins, Molecules, Scientific American Library, p. 93.
37. Taskin Tuna, Uzayin Otesi (Más Allá del Espacio), Bogazici Yayinlari, 1995, p. 166.